EXAMEN DES ARTICLES
Article 40
Reconnaissance des qualifications professionnelles des
infirmiers responsables de soins généraux formés en
Roumanie
Cet article vise à permettre, en application d'une nouvelle directive européenne, aux infirmiers roumains prouvant qu'ils ont achevé un programme spécial de mise à niveau de bénéficier de la reconnaissance automatique de leurs qualifications professionnelles au sein de l'Union européenne.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article modifié par un amendement rédactionnel.
I - Le dispositif proposé
A. La reconnaissance des qualifications professionnelles des infirmiers roumains
1. La reconnaissance des qualifications professionnelles dans l'Union européenne
· Le traité sur le fonctionnement de l'Union européenne (TFUE) consacre les principes de libre circulation des travailleurs à l'intérieur de l'Union, sous réserve des limitations justifiées par des raisons d'ordre public, de sécurité publique et de santé publique1(*), et de liberté d'établissement pour les activités non salariées2(*).
En application de ces principes, une directive européenne de 2005 sur la reconnaissance des qualifications professionnelles fixe les conditions dans lesquelles les États membres doivent reconnaître, pour l'accès à une profession réglementée et son exercice sur le territoire national, les qualifications professionnelles acquises dans un autre État membre et qui permettent au titulaire d'y exercer la même profession3(*).
Deux grands régimes de reconnaissance sont distingués par la directive.
Un régime général de reconnaissance des titres de formation permet, d'une part, l'exercice d'une profession réglementée dans l'État d'accueil aux titulaires d'un diplôme autorisant l'accès à la même profession dans un État membre de l'Union européenne sous réserve d'une mesure de compensation, lorsque la formation de l'intéressé diffère substantiellement de celle existant dans le pays d'accueil4(*). La mesure de compensation peut consister en un stage d'adaptation, d'une durée maximale de trois ans, ou en une épreuve d'aptitude5(*).
Un régime de reconnaissance automatique permet, d'autre part, aux demandeurs d'être autorisés à exercer leur profession réglementée sans comparaison de leurs qualifications aux exigences nationales. Celui-ci est notamment applicable :
- aux professions de l'artisanat, du commerce et de l'industrie, sur la base d'une reconnaissance de l'expérience professionnelle préalable de l'intéressé6(*) ;
- à sept professions pour lesquelles la directive fixe des conditions minimales de formation : les infirmiers responsables de soins généraux, les médecins, les sages-femmes, les praticiens de l'art dentaire, les pharmaciens, les vétérinaires et les architectes7(*).
Afin de favoriser la mobilité des intéressés et l'attractivité de la procédure, la procédure d'examen d'une demande visant à obtenir l'autorisation d'exercer une profession réglementée doit être achevée dans les plus brefs délais et, en principe, dans les trois mois à compter de la présentation du dossier complet de l'intéressé8(*).
· Si la procédure de reconnaissance des qualifications professionnelles dans l'Union européenne apparaît encore perfectible, elle est toutefois fréquemment utilisée par les professionnels de santé.
Dans un rapport d'audit récent, la Cour des comptes européenne relève ainsi que 6 % seulement des citoyens européens s'installant dans un autre État membre ont recours à la procédure de reconnaissance des qualifications professionnelles portée par la directive de 2005.
La Cour souligne, par ailleurs, plusieurs faiblesses dans la mise en oeuvre du dispositif, tenant au manque de procédures électroniques, aux frais de reconnaissance inégaux imposés par les États membres, à des demandes de documents excédant les exigences de la directive dans certains États et aux dépassements observés du délai maximal d'examen des dossiers9(*).
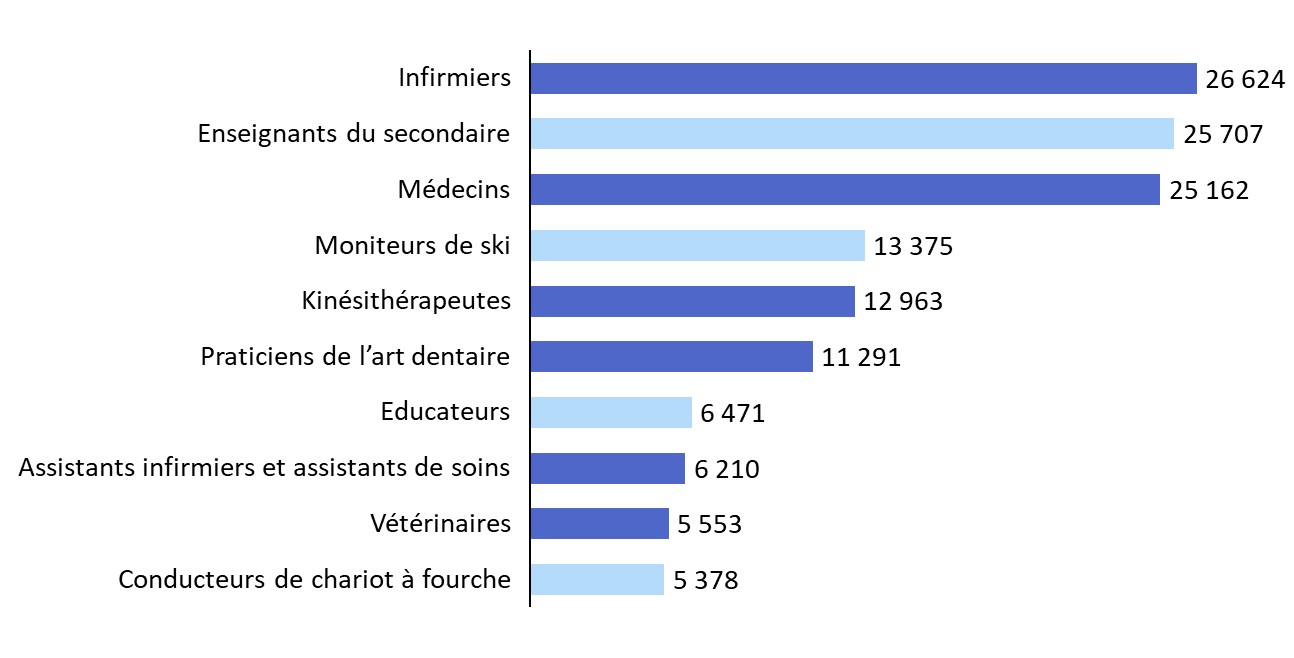
Les professions de santé figurent, toutefois, parmi les professions réglementées ayant le plus recours à la procédure. D'après la Cour des comptes européenne, les sept professions bénéficiant d'un régime de reconnaissance automatique sur la base de conditions minimales de formation concentreraient ainsi, à elles seules, 33 % des décisions de reconnaissance recensées depuis 201610(*). Les infirmiers, les médecins et les masseurs-kinésithérapeutes figurent parmi les cinq professions concentrant le plus grand nombre de décisions de reconnaissance entre 2017 et 202111(*).
Les dix professions ayant fait l'objet du plus grand nombre de décisions de reconnaissance des qualifications professionnelles entre 2017 et 2021
Source : commission des affaires sociales, d'après des données de la Cour des comptes européenne (2024)
2. Les conditions attachées à la reconnaissance des qualifications professionnelles des infirmiers roumains
· Le droit européen fixe les conditions minimales de formation dans lesquelles, comme cinq autres professions du secteur de la santé et les architectes, les infirmiers peuvent bénéficier d'une reconnaissance automatique de leurs qualifications professionnelles.
La directive de 2005 prévoit ainsi, d'abord, que la formation d'infirmier responsable de soins généraux doit comprendre au moins trois années d'études ou 4 600 heures d'enseignement théorique et clinique, la durée de l'enseignement théorique devant représenter au moins un tiers et celle de l'enseignement clinique au moins la moitié de la durée minimale de formation.
La formation doit, par ailleurs, donner la garantie que l'intéressé a acquis des connaissances et compétences listées par la directive. Figurent parmi celles-ci :
- une connaissance suffisante de l'organisme, des fonctions physiologiques et du comportement des personnes en bonne santé et des personnes malades ;
- une expérience clinique adéquate, acquise sous le contrôle d'un personnel infirmier qualifié ;
- une expérience de la collaboration avec d'autres professionnels de santé ;
- la capacité d'assurer, de façon indépendante, la qualité des soins infirmiers et leur évaluation12(*).
· Plusieurs exceptions aux exigences minimales sont, toutefois, prévues par la directive.
D'abord, ces exigences ne font pas obstacle aux droits acquis tirés par un ressortissant d'un État membre d'une qualification professionnelle qui, sans répondre aux exigences prévues, permet à son titulaire d'y exercer la profession. Cette exception s'applique, en particulier, dans le cas où l'État membre d'origine relève le niveau de formation requis pour l'accès à une profession mais permet aux titulaires des titres de formation antérieurs de continuer à l'exercer13(*).
La directive de 2005 relative aux qualifications professionnelles a ainsi permis la reconnaissance des titres de formation roumains obtenus avant l'adhésion de la Roumanie à l'Union européenne, qui ne répondaient pas aux exigences minimales fixées, lorsque ceux-ci étaient accompagnés d'un certificat déclarant que ces personnes avaient effectivement et légalement exercé en Roumanie pendant une période d'au moins cinq années consécutives au cours des sept années précédant la date de délivrance du certificat14(*). Une directive de 2013 a réduit la période d'exercice requise à au moins trois années consécutives au cours des cinq ans précédant la date de délivrance du certificat15(*).
Une directive de 2024, enfin, complète la directive de 2005 pour ouvrir le bénéfice de la reconnaissance automatique aux infirmiers attestant de la réalisation d'un programme spécial de mise à niveau permettant aux diplômés roumains de satisfaire aux exigences minimales européennes en matière de formation16(*). Ce programme de mise à niveau, mis en place par la Roumanie entre 2014 et 2019, aurait, d'après le ministère roumain de l'éducation et de la recherche, bénéficié à 23 diplômés de l'enseignement supérieur et plus de 3 000 diplômés de l'enseignement postsecondaire17(*).
· Le droit français a été progressivement adapté au cadre fixé par les directives européennes.
Le code de la santé publique permet, ainsi, l'exercice de la profession d'infirmier aux titulaires du diplôme français d'État d'infirmier et, lorsqu'ils sont ressortissants d'un État membre de l'Union européenne ou d'un État partie à l'accord sur l'Espace économique européen, aux titulaires d'un titre de formation d'infirmier responsable de soins généraux délivré par l'un de ces États conformément aux obligations communautaires18(*).
Depuis l'entrée en vigueur d'une ordonnance de 2017 relative à la reconnaissance des qualifications professionnelles dans le domaine de la santé19(*), le code de la santé publique permet également, en application de la directive de 2013, l'exercice de la profession d'infirmier aux titulaires d'un titre de formation d'infirmier responsable de soins généraux délivré par la Roumanie et non conforme aux obligations communautaires, s'il est accompagné d'une attestation certifiant que l'intéressé a exercé dans cet État, de façon effective et licite, les activités d'infirmier de soins généraux pendant au moins trois années consécutives au cours des cinq années précédant la date de l'attestation20(*).
Les bénéficiaires de la reconnaissance automatique de qualification sont tenus de se faire enregistrer auprès du conseil départemental de l'ordre des infirmiers, qui vérifie les pièces justificatives attestant de leur identité, de leur titre de formation ou de leur autorisation. L'exercice de la profession d'infirmier nécessite l'inscription au tableau de l'ordre. La liste des professionnels inscrits à ce tableau est portée à la connaissance du public21(*).
B. Le dispositif proposé : l'ouverture de la reconnaissance automatique aux infirmiers formés en Roumanie ayant suivi le programme spécial de mise à niveau
L'article 40 du présent projet de loi vise à tirer les conséquences de la directive de 2024 permettant la reconnaissance automatique des qualifications des infirmiers formés en Roumanie ayant suivi le programme spécial de mise à niveau mis en place par cet État membre entre 2014 et 2019.
Pour ce faire, il modifie l'article L. 4311-3 du code de la santé publique, relatif aux titres de formation exigés pour l'exercice en France de la profession d'infirmier.
Le 1° de l'article supprime, au e du 2° de l'article L. 4311-3 du code de la santé publique, la référence aux titres de formation roumains, désormais entièrement régis par le g du même 2°.
Le 2° de l'article réécrit l'actuel g du 2° de l'article L. 4311-3, pour permettre l'exercice de la profession d'infirmier aux titulaires d'un titre de formation délivré par la Roumanie et non conforme aux obligations communautaires :
- non plus seulement si ce titre est accompagné d'une attestation certifiant que l'intéressé a exercé en Roumanie, de façon effective et licite, les activités d'infirmier de soins généraux pendant au moins trois années consécutives au cours des cinq années précédant la date de l'attestation ;
- mais également si l'intéressé est titulaire d'un titre de formation sanctionnant le suivi d'un programme de mise à niveau.
La définition de la liste des titres de formation visés est renvoyée à un arrêté du ministre chargé de la santé.
La directive de février 2024 doit être transposée par les États membres, au plus tard, le 4 mars 202522(*). Saisi de ces dispositions, le Conseil d'État a estimé qu'elles n'appelaient pas d'observations particulières de sa part23(*).
II - Les modifications adoptées par l'Assemblée nationale
En commission de l'aménagement du territoire et du développement durable, l'article 40 a fait l'objet de deux amendements rédactionnels du rapporteur, Vincent Thiébaut.
L'Assemblée nationale a adopté cet article ainsi modifié.
III - La position de la commission
La commission a favorablement accueilli ces dispositions.
· Elle souligne l'intérêt, pour les systèmes de santé nationaux, d'une mobilité facilitée des professionnels au sein de l'Union européenne. Elle observe, à ce titre que les infirmiers et les médecins figurent parmi les professions ayant le plus fréquemment recours à la procédure de reconnaissance automatique des qualifications professionnelles mise en place au sein de l'Union européenne depuis le milieu des années 2000.
Interrogée sur la qualité du programme de mise à niveau mis en place, la direction générale de l'offre de soins (DGOS) confirme que celui-ci « permet aux infirmiers formés en Roumanie de s'aligner sur les exigences françaises, facilitant ainsi leur intégration dans le système de santé français ». Selon elle, ce programme « garantit une qualité de soins optimale tout en ouvrant des perspectives de carrière internationale »24(*).
À cet égard, la commission relève que la Cour des comptes européenne a récemment constaté la persistance de faiblesses importantes dans la procédure de reconnaissance des qualifications, et appelle à faciliter le parcours des professionnels concernés.
· La commission souligne que la profession infirmière connaît des tensions démographiques importantes, que le présent article ne contribuera toutefois que très marginalement à résoudre.
Si le nombre d'infirmiers en emploi augmente - il a crû de 8 % entre 2013 et 2021 pour s'établir, à cette date, à 600 000 en France -, ce dynamisme ne permettra pas de répondre à la hausse des besoins liée à l'augmentation et au vieillissement de la population. La direction de la recherche, des études, de l'évaluation et des statistiques (Drees) des ministères sociaux a ainsi estimé, dans une publication récente, qu'au rythme actuel de progression des effectifs, 80 000 infirmiers supplémentaires seraient nécessaires en 2050 pour assurer la même couverture de besoins en soins qu'actuellement25(*).
Le nombre d'infirmiers formés en Roumanie exerçant en France demeure, lui, relativement faible en comparaison à l'effectif de la profession. Interrogée par le rapporteur, la DGOS estime que 684 infirmiers détenteurs d'un diplôme roumain sont actuellement inscrits au tableau de l'ordre des infirmiers26(*).
Malgré ce constat, les dispositions du présent article apparaissent souhaitables pour favoriser l'exercice en France d'infirmiers formés en Roumanie et nécessaires pour adapter le code de la santé publique aux évolutions du droit européen. En conséquence, la commission propose leur adoption, sous réserve d'un amendement rédactionnel COM-88 de son rapporteur.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article ainsi modifié.
Article 41
Approvisionnement en dispositifs médicaux et
dispositifs médicaux de diagnostic in vitro
Cet article vise à adapter le droit national au nouveau dispositif européen de déclaration des interruptions et cessations d'approvisionnement en dispositifs médicaux et dispositifs médicaux de diagnostic in vitro, ainsi qu'à confier à l'Agence nationale de sécurité du médicament et des produits de santé des prérogatives de police sanitaire destinées à permettre la continuité des prises en charge en période de tension.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article modifié par deux amendements rédactionnels et de coordination.
I - Le dispositif proposé
A. L'enjeu de sécurisation de l'approvisionnement en dispositifs médicaux et sa prise en compte croissante par les droits français et européens
1. L'encadrement européen des dispositifs médicaux et les difficultés d'approvisionnement observées
· Les dispositifs médicaux et dispositifs médicaux de diagnostic in vitro font l'objet d'un encadrement européen, récemment renouvelé.
Le règlement (UE) n° 2017/745 relatif aux dispositifs médicaux (DM) définit ces derniers comme « tout instrument, appareil, équipement, logiciel, implant, réactif, matière ou autre article » destiné à être utilisé chez l'homme pour une ou plusieurs fins médicales et dont l'action principale voulue dans ou sur le corps humain n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme27(*).
Le règlement (UE) n° 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro (DMDIV) définit ces derniers comme « tout dispositif médical qui consiste en un réactif, un produit réactif, un matériau d'étalonnage, un matériau de contrôle, une trousse, un instrument, un appareil, un équipement, un logiciel ou un système (...) destiné par le fabricant à être utilisé in vitro dans l'examen d'échantillons provenant du corps humain »28(*).
Ces deux règlements ont visé à améliorer la sécurité des DM et DMDIV en étendant, notamment, les obligations :
- des fabricants, exploitants et distributeurs ;
- des organismes certifiés, chargés notamment de d'octroyer les marquages « CE » attestant de la conformité des dispositifs à la réglementation européenne et permettant leur commercialisation sur le marché européen.
Les règlements de 2017 ont également cherché à améliorer l'information des parties prenantes et la traçabilité des dispositifs, par la création d'une nouvelle base de données européenne Eudamed rassemblant les informations relatives aux DM et DMDIV commercialisés en Europe29(*).
L'obligation faite aux dispositifs précédemment certifiés d'obtenir un nouveau marquage CE, attestant de leur conformité aux exigences européennes, a suscité de vives inquiétudes chez l'ensemble des parties prenantes. La commission des affaires sociales observait qu'en octobre 2022, « près de 23 000 certificats de conformité aux anciennes directives européennes apparaissaient encore devoir être remplacés, laissant craindre que des dispositifs médicaux ne puissent plus être commercialisés ou que certains fabricants renoncent à leur certification »30(*).
Pour tenir compte de ces difficultés, la période transitoire au cours de laquelle un dispositif peut être commercialisé, sous certaines conditions, sans avoir encore obtenu un nouveau marquage CE a été plusieurs fois allongée, jusqu'au 31 décembre 2027 pour certaines catégories de dispositifs présentant un niveau élevé de risque, et jusqu'au 31 décembre 202831(*) ou 202932(*) pour les autres.
· Les difficultés associées au renouvellement des marquages CE contribuent à alimenter les craintes relatives à l'approvisionnement en DM et DMDIV.
En France, l'Agence nationale de sécurité des médicaments et des produits de santé (ANSM) indique constater un nombre croissant de ruptures ces dernières années, qu'elle attribue à « l'évolution des exigences réglementaires qui a notamment impliqué une restructuration du marché », au contexte géopolitique mondial et à son effet sur la disponibilité des matières premières, comme à diverses difficultés industrielles33(*).
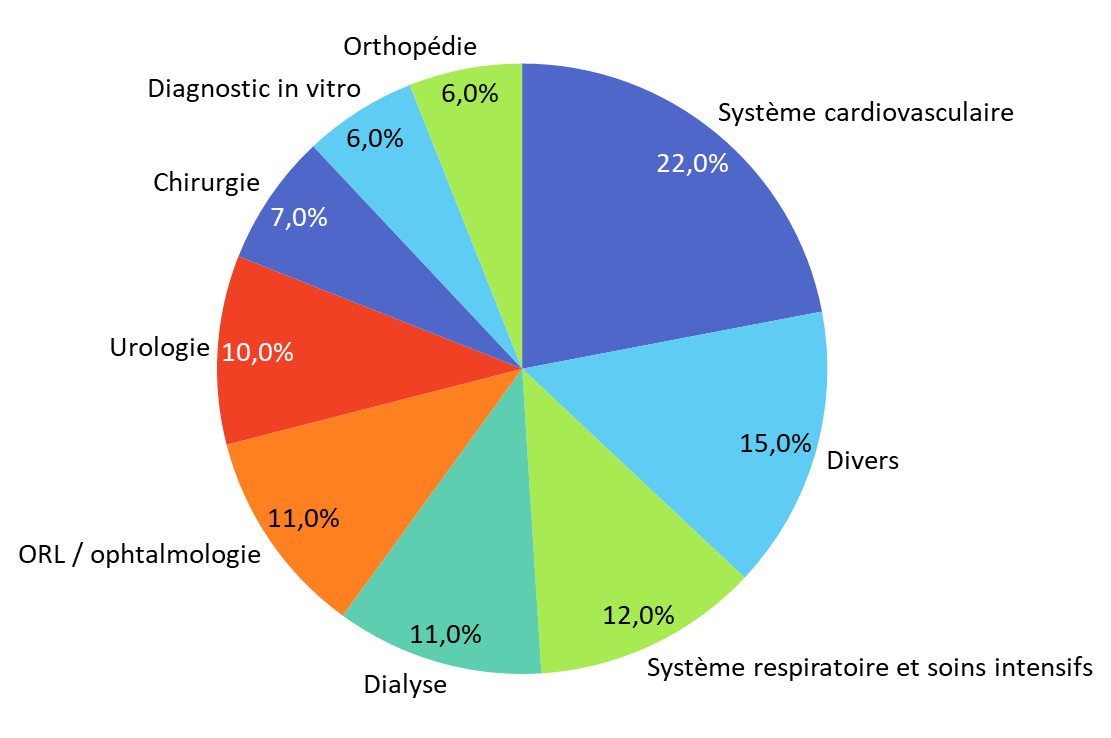
Ces signalements, fournis volontairement par les exploitants, les syndicats professionnels, les sociétés savantes ou les professionnels de santé, concerneraient une grande diversité de fabricants - multinationales, petites et moyennes entreprises, très petites entreprises - de catégories de dispositifs et d'aires thérapeutiques. Leur nombre aurait sensiblement augmenté ces dernières années, passant de 104 en 2022 à 149 en 2024.
Répartition des signalements réalisés en 2024 par aire thérapeutique
Source : commission des affaires sociales du Sénat, d'après des données transmises par l'ANSM
2. La prise en compte croissante des enjeux d'approvisionnement en France et en Europe
a) La mise en place de procédures de déclaration et de gestion des ruptures en France depuis 2021
Pour répondre aux ruptures observées et aux enjeux sanitaires associés, des procédures de sécurisation de l'approvisionnement en DM et DMDIV ont été mises en place, en France, ces dernières années.
· L'Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié en 2021, d'abord, une procédure de gestion anticipée des ruptures et risques de ruptures dans la disponibilité des DM et DMDIV dits « indispensables », dont l'indisponibilité entraînerait une situation de risque dans la prise en charge du patient34(*).
Mise à jour en septembre 202435(*), cette procédure vise notamment à permettre :
- l'évaluation par les opérateurs, sur la base d'une grille d'analyse des risques, de la criticité de tensions, de ruptures d'approvisionnement ou d'arrêts de commercialisation ;
- la gestion préventive par l'opérateur, en lien avec les utilisateurs et les acheteurs, des effets des tensions, ruptures ou arrêts de commercialisation identifiés ;
- l'intervention de l'ANSM, enfin, lorsque les actions mises en oeuvre ne suffisent pas à maîtriser les risques identifiés.
· En outre, le législateur a introduit dans le code de la santé publique en 202336(*) des procédures de déclaration à l'ANSM et de gestion de l'indisponibilité d'un DM ou d'un DMDIV.
Celles-ci font obligation aux fabricants, importateurs ou distributeurs qui identifient un risque de suspension ou de cessation de commercialisation d'un DM ou DMDIV indispensable, de mettre en oeuvre les mesures nécessaires pour éviter sa réalisation et, dans le cas où celles-ci se révèleraient insuffisantes, d'informer l'ANSM de l'existence de ce risque, sous peine de sanction financière. L'ANSM peut intervenir directement en cas en cas d'absence de déclaration et de mesures, ou lorsque ces dernières se révèlent insuffisantes37(*).
Toutefois, aucun des actes réglementaires nécessaires à leur application n'ayant été pris, ces dispositions sont demeurées inappliquées. Pour l'expliquer, le Gouvernement a mis en avant, dans le cadre du contrôle sénatorial de l'application des lois, les risques d'incompatibilité avec les évolutions récentes du droit de l'Union européenne en matière d'approvisionnement en DM et DMDIV38(*).
· Enfin, la loi de financement de la sécurité sociale (LFSS) pour 202539(*) crée un nouveau chapitre au sein du code de la santé publique relatif à la lutte contre les ruptures d'approvisionnement en dispositifs médicaux et porte des dispositions visant à permettre l'identification et la prise en charge de dispositifs médicaux alternatifs en cas de rupture.
Celles-ci permettent aux ministres chargés de la santé et de la sécurité sociale, lorsque l'interruption ou la cessation attendue de la fourniture d'un DM ou DMDIV est susceptible d'entraîner un préjudice grave ou un risque de préjudice grave pour les patients ou la santé publique, de déterminer par arrêté, pris sur proposition de l'ANSM, les dispositifs médicaux alternatifs et les conditions dérogatoires de leur prise en charge par l'assurance maladie40(*).
b) Les développements récents du dispositif européen Eudamed
Un règlement européen de juin 202441(*) a complété les règlements de 2017 relatifs aux DM et DMDIV pour y insérer de nouvelles dispositions relatives aux obligations de déclaration des opérateurs en cas d'interruption ou de cessation de la fourniture de certains dispositifs.
· Ce nouveau dispositif, permettant l'alimentation de la base de données Eudamed, fait obligation aux fabricants de DM ou DMDIV qui anticipent une interruption ou une cessation d'approvisionnement, lorsqu'il est raisonnablement prévisible que cette interruption ou cessation pourrait entraîner un préjudice grave ou un risque de préjudice grave pour les patients ou la santé publique dans un ou plusieurs États membres, d'informer :
- l'autorité compétente de l'État membre dans lequel ils sont établis ;
- les opérateurs économiques, les établissements de santé et professionnels de santé auxquels ils fournissent directement les dispositifs concernés.
Cette information doit être communiquée, sauf circonstances exceptionnelles, au moins six mois avant l'interruption ou la cessation attendue et préciser ses motifs.
· Les règlements européens relatifs aux DM et DMDIV font également, désormais, obligation :
- à l'autorité compétente qui a reçu l'information, d'informer sans retard injustifié les autorités compétentes des autres États membres et la Commission ;
- aux opérateurs économiques qui ont reçu l'information, d'informer sans retard injustifié tout autre opérateur économique, les établissements de santé et les professionnels de santé auxquels ils fournissent directement les dispositifs concernés42(*).
L'objectif affiché de ce nouveau dispositif est de permettre aux autorités compétentes et aux établissements de santé « de prendre des mesures d'atténuation si nécessaire afin de garantir la santé et la sécurité des patients »43(*).
B. Le dispositif proposé : l'adaptation du droit national au nouveau dispositif déclaratif européen
L'article 41 du présent projet de loi vise à tirer les conséquences, en droit interne, du dispositif déclaratif porté par le règlement européen 2024/1860 de juin 2024.
· Pour ce faire, les 1° et 3° du I réécrivent les articles L. 5211-5-1 et L. 5221-7 du code de la santé publique, qui portaient les dispositions relatives à la procédure de déclaration et de gestion des indisponibilités des DM et DMDIV adoptées par le Parlement en 2023 et demeurées inappliquées.
Désormais, ces articles prévoiraient que, lorsqu'elle est informée conformément à l'obligation européenne de l'interruption ou de la cessation attendue de la fourniture d'un DM ou d'un DMDIV, et lorsqu'elle estime que cette interruption ou cessation est susceptible d'entraîner un préjudice grave ou un risque de préjudice grave pour les patients ou la santé publique, l'ANSM prend les mesures strictement nécessaires et proportionnées afin d'assurer la continuité de la prise en charge de l'état de santé des patients.
Les dispositions précisent que, dans de telles circonstances, l'ANSM :
- publie sur son site internet les informations relatives aux interruptions ou cessations de fourniture des dispositifs concernés ;
- peut émettre des recommandations comportant notamment des solutions alternatives et des mesures d'information et d'accompagnement des professionnels et des patients, ces recommandations étant, le cas échéant, publiées sur le site internet de l'agence ;
- peut soumettre à des conditions particulières, restreindre ou suspendre l'exploitation, l'exportation, la distribution en gros, le conditionnement, la mise sur le marché à titre gratuit ou onéreux, la détention en vue de la vente ou la distribution à titre gratuit, la publicité, la mise en service, la prescription, la délivrance ou l'utilisation du dispositif concerné.
Il doit être mis fin sans délai à ces mesures lorsqu'elles cessent d'être nécessaires pour assurer la continuité de la prise en charge de l'état de santé des patients.
Afin de permettre l'évaluation des effets de l'interruption ou de la cessation attendue et des mesures nécessaires à la continuité de la prise en charge, ainsi que la mise en oeuvre des mesures prises à ce titre, le fabricant ou son mandataire doit communiquer à l'ANSM les informations qu'elle sollicite.
L'étude d'impact jointe au présent projet de loi précise que, sur le modèle du médicament, ces dispositions permettront notamment à l'ANSM d'imposer aux fabricants l'organisation d'un contingentement qualitatif ou quantitatif, permettant de restreindre l'utilisation d'un dispositif médical à l'une de ses indications, aux patients les plus à risque, à certains professionnels de santé ou établissements44(*).
· Les 2° et 4° du I de l'article 41 complètent les articles L. 5211-6 et L. 5221-8 du code de la santé publique pour prévoir qu'en matière, respectivement, de DM et de DMDIV, des décrets en Conseil d'État pourront déterminer :
- les modalités d'information de l'ANSM, des opérateurs économiques, des établissements de santé et des professionnels de santé en application des règlements européens relatifs aux DM et DMDIV modifiés ;
- les modalités de définition, après une procédure contradictoire adaptée aux circonstances, des mesures que l'ANSM estime nécessaires à la continuité de la prise en charge et des conditions de leur mise en oeuvre, ainsi que les règles applicables à la transmission des informations demandées par l'ANSM au fabricant ou au mandataire d'un DM ou d'un DMDIV.
· Les 5° et 6° du I modifient et complètent les articles L. 5461-9 et L. 5462-8 du code de la santé publique pour soumettre à sanctions financières :
- le fait, pour le fabricant d'un DM ou d'un DMDIV établi en France ou dont le mandataire est établi en France, de ne pas informer dans les conditions prévues par les règlements européens de l'interruption ou de la cessation attendue de la fourniture d'un dispositif l'ANSM, ainsi que les opérateurs économiques, les établissements de santé et les professionnels de santé auxquels il fournit directement le dispositif concerné ;
- le fait, pour le fabricant d'un DM ou d'un DMDIV établi en France ou dont le mandataire est établi en France, de ne pas respecter les mesures prises par l'ANSM pour assurer la continuité de la prise en charge ou de ne pas répondre aux demandes d'informations qu'elle lui adresse ;
- le fait, pour les opérateurs économiques informés par le fabricant, son mandataire ou tout autre opérateur économique de l'interruption ou de la cessation attendue de la fourniture d'un DM ou d'un DMDIV, de ne pas en informer les autres opérateurs économiques, les établissements de santé et les professionnels de santé auxquels ils fournissent directement le dispositif conformément aux règlements européens.
· Le 7° du I de l'article 41 modifie l'article L. 5471-1 du code de la santé publique, fixant les montants maximaux des sanctions financières que l'ANSM peut prononcer, pour soumettre les manquements précités à une sanction maximale de 150 000 € pour une personne physique et 50 % du chiffre d'affaires réalisé lors du dernier exercice clos pour le dispositif concerné, dans la limite de cinq millions d'euros, pour une personne morale.
L'ANSM pourra également décider de publier les décisions de sanction financière prononcées à ce titre sur son site internet.
· Les 8° et 9° du I modifient les articles L. 5522-1 et L. 5524-1 du code de la santé publique pour rendre les dispositions portées par le présent article applicables à Wallis-et-Futuna.
· Enfin, le II de l'article 41 prévoit que celui-ci entre en vigueur le 10 janvier 2025.
Les obligations déclaratives portées par le règlement européen de 2024 sont, en effet, applicables à compter de cette date45(*).
II - Les modifications adoptées par l'Assemblée nationale
· En commission de l'aménagement du territoire et du développement durable, l'article 41 a fait l'objet de deux amendements rédactionnels du rapporteur, Vincent Thiébaut.
Un amendement du rapporteur, supprimant les dispositions du II qui fixaient la date d'entrée en vigueur du dispositif au 10 janvier 2025, a, par ailleurs, été adopté compte tenu des délais d'examen parlementaire constatés.
· En séance plénière, l'Assemblée nationale a adopté un amendement rédactionnel du rapporteur.
L'Assemblée nationale a adopté cet article ainsi modifié.
III - La position de la commission
La commission a favorablement accueilli les dispositions du présent article.
· Elle observe, d'abord, que celui-ci transpose correctement en droit interne les dispositions du règlement européen de 2024 instaurant des obligations de déclaration à destination des fabricants de DM et DMDIV et des opérateurs économiques, lorsqu'une interruption ou une cessation prévisible d'approvisionnement risque d'entraîner un préjudice grave pour les patients ou la santé publique.
Le Conseil d'État estime ainsi, dans son avis publié sur le présent projet de loi, que les dispositions relatives aux sanctions portées par l'article 41 se bornent à tirer les conséquences nécessaires du règlement européen et n'appellent, à ce titre, aucune observation de sa part46(*).
· La commission a, en outre, soutenu les dispositions du présent article permettant à l'ANSM de prendre des mesures de police sanitaire nécessaires à la continuité des prises en charge en période de tension d'approvisionnement.
La commission s'est, plusieurs fois, montrée attachée à une meilleure anticipation et à une meilleure gestion des difficultés d'approvisionnement observées dans le secteur des DM et DMDIV. Observant que « contrairement aux médicaments, aucune disposition du code de la santé publique ne permet de lutter efficacement contre les phénomènes de rupture de DM et DMDIV », elle avait porté, en 2023, l'amendement à l'origine des dispositions instaurant une nouvelle procédure de déclaration et de gestion de l'indisponibilité d'un dispositif47(*).
La commission juge que le présent article, qui remplace les dispositions adoptées en 2023 et demeurées inappliquées par de nouvelles dispositions, adaptées au règlement européen de 2024, poursuit de manière satisfaisante le même objectif.
Elle observe, au surplus, que le Conseil d'État, dans son avis consultatif précité, a jugé que les dispositions confiant de nouvelles prérogatives à l'ANSM relevaient bien de la compétence des autorités nationales « pour organiser, en complément du dispositif de l'Union européenne, un régime de police administrative spéciale afin de prévenir les conséquences à l'égard des patients et de la santé publique d'une pénurie de dispositifs médicaux et notamment d'assurer la continuité de la prise en charge de l'état de santé des patients. »48(*)
Enfin, le rapporteur relève que les représentants du secteur, auditionnés, ont jugé les nouvelles prérogatives confiées à l'ANSM utiles en période de tension d'approvisionnement49(*).
Tenant compte de l'ensemble de ces éléments, la commission propose d'adopter les présentes dispositions sous réserve d'un amendement COM-89 de coordination juridique et d'un amendement rédactionnel COM-90 de son rapporteur.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article ainsi modifié.
* 1 Article 45 du traité sur le fonctionnement de l'Union européenne.
* 2 Article 49 du traité sur le fonctionnement de l'Union européenne.
* 3 Article 1er de la directive 2005/36/CE du Parlement européen et du Conseil du 7 septembre 2005 relative à la reconnaissance des qualifications professionnelles.
* 4 Article 13 de la directive 2005/36/CE précitée.
* 5 Article 14 de la directive 2005/36/CE précitée.
* 6 Articles 16 et suivants de la directive 2005/36/CE précitée.
* 7 Article 21 de la directive 2005/36/CE précitée.
* 8 Article 51 de la directive 2005/36/CE précitée.
* 9 Cour des comptes européenne, Reconnaissance des qualifications professionnelles dans l'Union européenne. Un mécanisme essentiel, mais utilisé de manière sporadique et incohérente, 2024.
* 10 Ibid., p. 12.
* 11 Ibid., p. 10.
* 12 Article 31 de la directive 2005/36/CE précitée.
* 13 Article 12 de la directive 2005/36/CE précitée.
* 14 Article 33 bis de la directive 2005/36/CE précitée, dans sa version en vigueur au 1er janvier 2007.
* 15 Directive 2013/55/UE du Parlement européen et du Conseil du 20 novembre 2013 modifiant la directive 2005/36/CE relative à la reconnaissance des qualifications professionnelles.
* 16 Directive 2024/505/UE du Parlement européen et du Conseil du 7 février 2024 modifiant la directive 2005/36/CE en ce qui concerne la reconnaissance des qualifications professionnelles des infirmiers responsables de soins généraux formés en Roumanie.
* 17 Données citées par l'étude d'impact jointe au présent projet de loi, p. 571.
* 18 Article L. 4311-3 du code de la santé publique.
* 19 Ordonnance n° 2017-50 du 19 janvier 2017 relative à la reconnaissance des qualifications professionnelles dans le domaine de la santé.
* 20 Article L. 4311-3 du code de la santé publique.
* 21 Article L. 4311-15 et D. 4311-95 du code de la santé publique.
* 22 Article 2 de la directive 2024/505/UE précitée.
* 23 Avis consultatif du Conseil d'État du 4 novembre 2024 sur le présent projet de loi.
* 24 Réponses écrites de la DGOS au questionnaire transmis par le rapporteur.
* 25 Drees, Le nombre d'infirmières augmenterait fortement d'ici à 2050, mais moins que les besoins en soins de la population vieillissante, décembre 2024.
* 26 Réponses écrites de la DGOS au questionnaire transmis par le rapporteur.
* 27 Article 2 du règlement (UE) 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux, modifiant la directive 2001/83/CE, le règlement (CE) n° 178/2002 et le règlement (CE) n° 1223/2009.
* 28 Article 2 du règlement (UE) 2017/746 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux de diagnostic in vitro et abrogeant la directive 98/79/CE et la décision 2010/227/UE de la Commission.
* 29 Articles 33 du règlement (UE) 2017/745 et 30 du règlement (UE) 2017/746 précités.
* 30 Pascale Gruny, rapport n° 186 (2022-2023) sur le projet de loi portant diverses dispositions d'adaptation au droit de l'Union européenne dans les domaines de l'économie, de la santé, du travail, des transports et de l'agriculture, 7 décembre 2022, p. 81.
* 31 Règlement (UE) 2023/607 du Parlement européen et du Conseil du 15 mars 2023 modifiant les règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne les dispositions transitoires relatives à certains dispositifs médicaux et à certains dispositifs médicaux de diagnostic in vitro.
* 32 Règlement (UE) 2024/1860 du Parlement européen et du Conseil du 13 juin 2024 modifiant les règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne un déploiement progressif d'Eudamed, l'obligation d'informer en cas d'interruption ou de cessation d'approvisionnement et les dispositions transitoires applicables à certains dispositifs médicaux de diagnostic in vitro.
* 33 Réponses écrites de l'ANSM au questionnaire transmis par le rapporteur.
* 34 Communiqué de l'ANSM « Indisponibilité d'un dispositif médical : l'ANSM publie une procédure de gestion préventive pour les opérateurs du marché » publié le 4 août 2021.
* 35 Communiqué de l'ANSM « Déclarer l'indisponibilité d'un dispositif médical : la procédure évolue » publié le 5 juillet 2024.
* 36 Article 27 de la loi n° 2023-171 du 9 mars 2023 portant diverses dispositions d'adaptation au droit de l'Union européenne dans les domaines de l'économie, de la santé, du travail, des transports et de l'agriculture.
* 37 Articles L. 5211-5-1 et L. 5221-7 du code de la santé publique.
* 38 Sylvie Vermeillet, rapport d'information n° 624 (2023-2024) sur le bilan annuel de l'application des lois au 31 mars 2024, déposé le 22 mai 2024, p. 266.
* 39 Article 75 de la loi n° 2025-199 du 28 février 2025 de financement de la sécurité sociale pour 2025.
* 40 Article L. 5215-1 du code de la santé publique.
* 41 Règlement (UE) 2024/1860 du Parlement européen et du Conseil du 13 juin 2024 modifiant les règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne un déploiement progressif d'Eudamed, l'obligation d'informer en cas d'interruption ou de cessation d'approvisionnement et les dispositions transitoires applicables à certains dispositifs médicaux de diagnostic in vitro.
* 42 Articles 10 bis des règlements (UE) 2017/745 et 2017/746 précités.
* 43 Considérant n° 15 du règlement (UE) 2024/1860 précité.
* 44 Étude d'impact jointe au présent projet de loi, p. 580.
* 45 Article 3 du règlement (UE) 2024/1860 précité.
* 46 Avis consultatif du Conseil d'État sur le présent projet de loi.
* 47 Amendement COM-11 de Mme Gruny, rapporteur, adopté par la commission des affaires sociales du Sénat le 6 décembre 2022 dans le cadre de l'examen du projet de loi n° 140 (2022-2023) portant diverses dispositions d'adaptation au droit de l'Union européenne dans les domaines de l'économie, de la santé, du travail, des transports et de l'agriculture.
* 48 Avis consultatif du Conseil d'État sur le présent projet de loi.
* 49 Réponses écrites du Snitem et du Sidiv au questionnaire transmis par le rapporteur.