- L'ESSENTIEL
- EXAMEN DES ARTICLES
- EXAMEN EN COMMISSION
- RÈGLES RELATIVES À L'APPLICATION DE
L'ARTICLE 45
DE LA CONSTITUTION ET DE L'ARTICLE 44 BIS
DU RÈGLEMENT DU SÉNAT (« CAVALIERS »)
- LISTE DES PERSONNES ENTENDUES
- LA LOI EN CONSTRUCTION
N° 392
SÉNAT
SESSION ORDINAIRE DE 2024-2025
Enregistré à la Présidence du Sénat le 4 mars 2025
AVIS
PRÉSENTÉ
au nom de la commission des affaires sociales (1) sur le projet de loi, adopté par l'Assemblée nationale après engagement de la procédure accélérée, portant diverses dispositions d'adaptation au droit de l'Union européenne en matière économique, financière, environnementale, énergétique, de transport, de santé et de circulation des personnes,
Par M. Khalifé KHALIFÉ,
Sénateur
(1) Cette commission est composée de : M. Philippe Mouiller, président ; Mme Élisabeth Doineau, rapporteure générale ; Mme Pascale Gruny, M. Jean Sol, Mme Annie Le Houerou, MM. Bernard Jomier, Olivier Henno, Xavier Iacovelli, Mmes Cathy Apourceau-Poly, Véronique Guillotin, M. Daniel Chasseing, Mme Raymonde Poncet Monge, vice-présidents ; Mmes Viviane Malet, Annick Petrus, Corinne Imbert, Corinne Féret, Jocelyne Guidez, secrétaires ; Mmes Marie-Do Aeschlimann, Christine Bonfanti-Dossat, Corinne Bourcier, Céline Brulin, M. Laurent Burgoa, Mmes Marion Canalès, Maryse Carrère, Catherine Conconne, Patricia Demas, Chantal Deseyne, Brigitte Devésa, M. Jean-Luc Fichet, Mme Frédérique Gerbaud, M. Khalifé Khalifé, Mmes Florence Lassarade, Marie-Claude Lermytte, Monique Lubin, Brigitte Micouleau, M. Alain Milon, Mmes Laurence Muller-Bronn, Solanges Nadille, Anne-Marie Nédélec, Guylène Pantel, M. François Patriat, Mmes Émilienne Poumirol, Frédérique Puissat, Marie-Pierre Richer, Anne-Sophie Romagny, Laurence Rossignol, Silvana Silvani, Nadia Sollogoub, Anne Souyris, MM. Dominique Théophile, Jean-Marie Vanlerenberghe.
Voir les numéros :
|
Assemblée nationale (17ème législ.) : |
529, 631 et T.A. 53 |
|
|
Sénat : |
352, 389 et 390 (2024-2025) |
|
L'ESSENTIEL
La commission des affaires sociales a reçu délégation au fond pour l'examen des articles 40 et 41 du projet de loi, relatifs à la reconnaissance des qualifications professionnelles des infirmiers formés en Roumanie et à l'approvisionnement en dispositifs médicaux.
Elle propose d'adopter ces deux articles, modifiés par trois amendements de son rapporteur.
*
**
I. LA RECONNAISSANCE DES QUALICATIONS PROFESSIONNELLES DES INFIRMIERS FORMÉS EN ROUMANIE
A. LE DISPOSITIF DE RECONNAISSANCE DES QUALIFICATIONS PROFESSIONNELLES AU SEIN DE L'UNION EUROPÉENNE
La reconnaissance facilitée des qualifications professionnelles au sein de l'Union européenne constitue un corollaire des principes de libre circulation des travailleurs à l'intérieur de l'Union et de liberté d'établissement pour les activités non salariées, consacrés par les traités.
Une directive de 2005, plusieurs fois modifiée, instaure deux grands régimes de reconnaissance :
- un régime dit « général » de reconnaissance des titres de formation, permettant l'exercice d'une profession réglementée dans l'Union aux titulaires d'un diplôme autorisant l'accès à la même profession dans un État membre, sous réserve de mesures de compensation en cas d'écart substantiel de formation avec celle exigée dans le pays d'accueil ;
- un régime de reconnaissance automatique, sans comparaison des qualifications du demandeur aux exigences nationales, applicable notamment à sept professions pour lesquelles la directive fixe des conditions minimales de formation : les infirmiers, les médecins, les sages-femmes, les praticiens de l'art dentaire, les pharmaciens, les vétérinaires et les architectes.
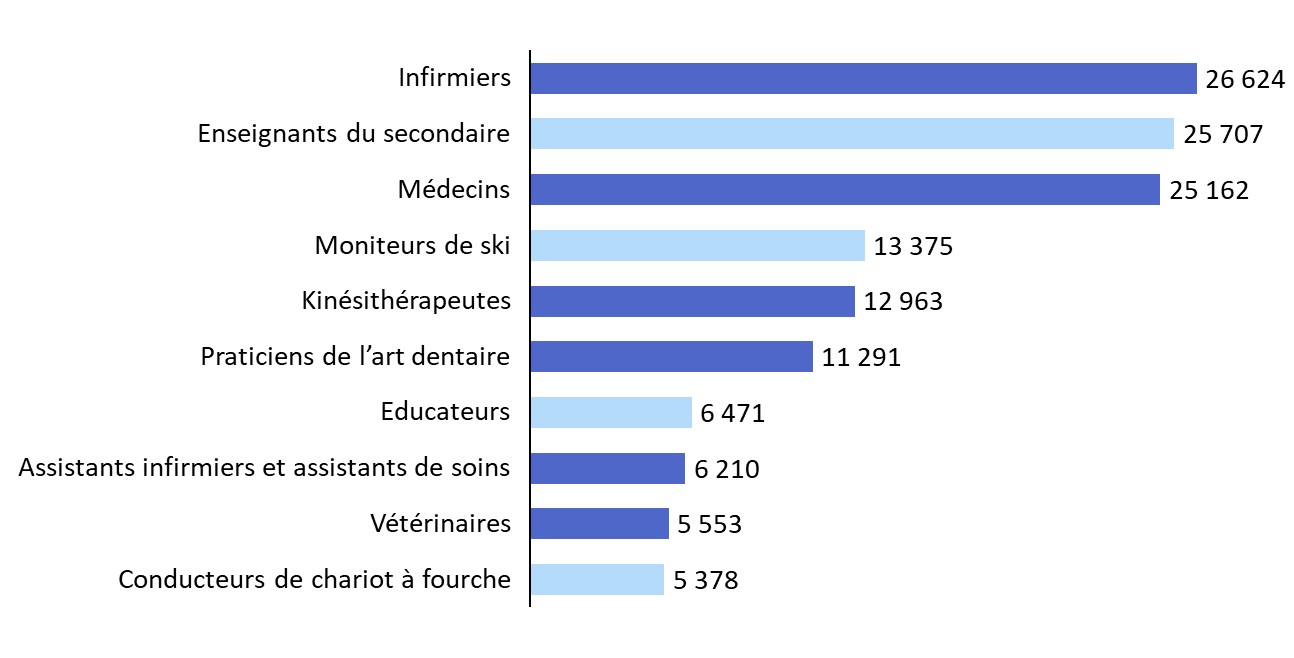
Les professions de santé figurent parmi les principaux bénéficiaires du dispositif. Entre 2017 et 2021, plus de 25 000 infirmiers et plus de 25 000 médecins auraient ainsi, d'après la Cour des comptes européenne, bénéficié d'une reconnaissance des qualifications, ces effectifs les classant parmi les trois professions qui ont le plus recours à la procédure.
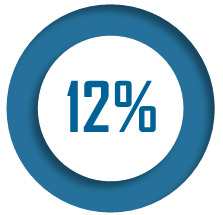
Pour autant, parmi les infirmiers exerçant en France, la part de ceux qui ont été formés à l'étranger demeure faible. Selon la direction de la recherche, des études, de l'évaluation et des statistiques (Drees) des ministères sociaux, en 2021, 12 % des médecins et 3 % des infirmiers exerçant en France ont été formés dans un autre pays. Cette proportion a progressé, entre 2011 et 2021, de 4 points de pourcentage pour les médecins et de 0,5 point pour les infirmiers.
Part des professionnels exerçant en France formés à l'étranger en 2021
B. UN ASSOUPLISSEMENT SOUHAITABLE DES CONDITIONS DE RECONNAISSANCE AUTOMATIQUE DES INFIRMIERS FORMÉS EN ROUMANIE
Lors de l'intégration de la Roumanie à l'Union européenne, la formation roumaine des infirmiers ne respectait pas les exigences minimales portées par la directive européenne de 2005 pour la reconnaissance automatique des qualifications des infirmiers responsables de soins généraux. Celle-ci prévoit que la formation doit comprendre au moins trois années ou 4 600 heures d'enseignements, donnant la garantie que l'étudiant dispose d'une expérience clinique adéquate et soit capable d'assurer, de manière indépendante, la qualité des soins infirmiers.
Toutefois, la directive a permis la reconnaissance des titres de formation roumains obtenus avant l'adhésion de la Roumanie, lorsque ceux-ci étaient accompagnés d'un certificat attestant de l'expérience professionnelle de l'intéressé. La période d'exercice, initialement fixée à cinq années consécutives au cours des sept années précédant la délivrance du certificat, a été ramenée à trois années consécutives au cours des cinq années précédentes.
Ces exceptions ont été transposées dans le code de la santé publique, qui confie aux conseils départementaux de l'ordre des infirmiers le soin de vérifier les pièces justificatives transmises à l'appui d'une demande de reconnaissance. D'après le ministère, 684 infirmiers détenteurs d'un diplôme roumain seraient ainsi, actuellement, inscrits au tableau de l'ordre.
Une directive de 2024 a, par ailleurs, assoupli ce régime en ouvrant le bénéfice de la reconnaissance automatique aux infirmiers formés en Roumanie qui, sans satisfaire aux exigences minimales européennes, attesteraient de la réalisation d'un programme spécial de mise à niveau mis en place par la Roumanie entre 2014 et 2019. D'après le Gouvernement roumain, ce programme aurait bénéficié à plus de 3 000 diplômés.
L'article 40 du présent projet de loi vise à transposer cette évolution en droit national.
La commission a soutenu ces dispositions, soulignant l'intérêt pour les systèmes de santé nationaux d'une mobilité facilitée des professionnels au sein de l'Union.
II. L'APPROVISIONNEMENT EN DISPOSITIFS MÉDICAUX
A. DES DIFFICULTÉS D'APPROVISIONNEMENT GRANDISSANTES
Le cadre juridique applicable aux dispositifs médicaux (DM) et aux dispositifs médicaux de diagnostic in vitro (DMDIV) a été profondément renouvelé par l'entrée en vigueur de deux nouveaux règlements européens en 2017. Ceux-ci ont notamment cherché à renforcer la sécurité des patients et la transparence du marché en :
- étendant les obligations applicables aux fabricants, exploitants, distributeurs et organismes certifiés, ces derniers étant chargés d'octroyer les marquages « CE » attestant de la conformité des dispositifs à la réglementation et permettant leur commercialisation ;
- créant une nouvelle base de données européenne Eudamed rassemblant les informations relatives aux DM et DMDIV commercialisés dans l'Union.
En application de ces règlements, les dispositifs précédemment certifiés doivent obtenir un nouveau marquage CE, à l'issue d'une période transitoire. Plusieurs textes postérieurs ont allongé cette période, afin de tenir compte de l'engorgement observé et du risque que des exploitants choisissent de renoncer à la commercialisation de certains de leurs dispositifs.
Ces difficultés ont contribué à alimenter, ces dernières années, les craintes relatives à l'approvisionnement en DM et DMDIV. En France, le nombre de ruptures signalées à l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) a considérablement augmenté depuis la crise sanitaire.
Nombre de signalements de ruptures de DM et DMDIV adressées à l'ANSM
Source : données transmises par l'Agence nationale de sécurité du médicament
Les ruptures signalées apparaissent multifactorielles et touchent une grande diversité de dispositifs. Selon l'ANSM, 37 % d'entre elles seraient dues à des difficultés d'approvisionnement et 28 % à un arrêt de commercialisation. Les ruptures signalées concernent l'ensemble des aires thérapeutiques et peuvent toucher des dispositifs indispensables à la prise en charge des patients - canules veineuses, pousses-seringues, etc.
B. UN RENFORCEMENT NÉCESSAIRE DES OUTILS DE SÉCURISATION DE L'APPROVISIONNEMENT EN FRANCE ET EN EUROPE
En réponse à ces difficultés, la France et l'Union européenne ont progressivement mis en place des outils de sécurisation de l'approvisionnement ces dernières années.
L'ANSM a établi, depuis 2021, une procédure de gestion anticipée des ruptures et risques de ruptures, impliquant les opérateurs dans l'évaluation et la maîtrise des risques associés.
Par ailleurs et à l'initiative du Sénat, le législateur a, en 2023, introduit des procédures de gestion de l'indisponibilité des DM ou DMDIV. Celles-ci font notamment obligation aux exploitants identifiant un risque d'agir pour éviter sa réalisation et d'informer l'ANSM de l'existence de ce risque, sous peine de sanction financière. Les actes réglementaires nécessaires à l'application de ces dispositions n'ayant pas été pris, celles-ci sont toutefois demeurées inappliquées.
La loi de financement de la sécurité sociale (LFSS) pour 2025 a, en outre, porté des dispositions visant à permettre l'identification et la prise en charge de DM alternatifs en cas de rupture.
Enfin, un règlement européen de 2024 a étendu le dispositif Eudamed en faisant obligation :
- aux fabricants anticipant une interruption ou une cessation d'approvisionnement susceptible d'entraîner un préjudice grave pour les patients ou la santé publique, d'informer l'autorité nationale compétente, ainsi que les opérateurs économiques, les établissements et professionnels de santé auxquels ils fournissent directement le dispositif ;
- à l'autorité nationale compétente, d'informer ses homologues européens et la Commission ;
- aux opérateurs économiques ayant reçu l'information, d'informer tout autre opérateur, établissement ou professionnel de santé auxquels ils fournissent directement le dispositif.
L'article 41 du présent projet de loi tire les conséquences de ce règlement en droit national en soumettant à des sanctions financières les fabricants ou opérateurs économiques qui ne respecteraient pas leurs obligations déclaratives. Il permet, en outre, à l'ANSM de prendre, dans de telles circonstances, des mesures de police sanitaire strictement nécessaires et proportionnées afin d'assurer la continuité des prises en charge en :
- publiant sur son site internet les informations relatives aux interruptions ou cessations d'approvisionnement ;
- émettant des recommandations à destination des professionnels et des patients ;
- soumettant à des conditions particulières, restreignant ou suspendant l'exploitation, l'exportation, la distribution en gros, le conditionnement, la mise sur le marché, la détention, la publicité, la mise en service, la prescription, la délivrance ou l'utilisation du dispositif.
La commission a soutenu sans réserve ces dispositions, rapprochant les prérogatives de l'ANSM en matière de dispositifs médicaux de celles dont dispose l'agence pour lutter contre les pénuries de médicaments.
Réunie le mardi 4 mars 2025 sous la présidence de Philippe Mouiller, la commission des affaires sociales propose d'adopter, avec des modifications rédactionnelles et de coordination, les articles 40 et 41.
EXAMEN DES ARTICLES
Article 40
Reconnaissance des qualifications professionnelles des
infirmiers responsables de soins généraux formés en
Roumanie
Cet article vise à permettre, en application d'une nouvelle directive européenne, aux infirmiers roumains prouvant qu'ils ont achevé un programme spécial de mise à niveau de bénéficier de la reconnaissance automatique de leurs qualifications professionnelles au sein de l'Union européenne.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article modifié par un amendement rédactionnel.
I - Le dispositif proposé
A. La reconnaissance des qualifications professionnelles des infirmiers roumains
1. La reconnaissance des qualifications professionnelles dans l'Union européenne
· Le traité sur le fonctionnement de l'Union européenne (TFUE) consacre les principes de libre circulation des travailleurs à l'intérieur de l'Union, sous réserve des limitations justifiées par des raisons d'ordre public, de sécurité publique et de santé publique1(*), et de liberté d'établissement pour les activités non salariées2(*).
En application de ces principes, une directive européenne de 2005 sur la reconnaissance des qualifications professionnelles fixe les conditions dans lesquelles les États membres doivent reconnaître, pour l'accès à une profession réglementée et son exercice sur le territoire national, les qualifications professionnelles acquises dans un autre État membre et qui permettent au titulaire d'y exercer la même profession3(*).
Deux grands régimes de reconnaissance sont distingués par la directive.
Un régime général de reconnaissance des titres de formation permet, d'une part, l'exercice d'une profession réglementée dans l'État d'accueil aux titulaires d'un diplôme autorisant l'accès à la même profession dans un État membre de l'Union européenne sous réserve d'une mesure de compensation, lorsque la formation de l'intéressé diffère substantiellement de celle existant dans le pays d'accueil4(*). La mesure de compensation peut consister en un stage d'adaptation, d'une durée maximale de trois ans, ou en une épreuve d'aptitude5(*).
Un régime de reconnaissance automatique permet, d'autre part, aux demandeurs d'être autorisés à exercer leur profession réglementée sans comparaison de leurs qualifications aux exigences nationales. Celui-ci est notamment applicable :
- aux professions de l'artisanat, du commerce et de l'industrie, sur la base d'une reconnaissance de l'expérience professionnelle préalable de l'intéressé6(*) ;
- à sept professions pour lesquelles la directive fixe des conditions minimales de formation : les infirmiers responsables de soins généraux, les médecins, les sages-femmes, les praticiens de l'art dentaire, les pharmaciens, les vétérinaires et les architectes7(*).
Afin de favoriser la mobilité des intéressés et l'attractivité de la procédure, la procédure d'examen d'une demande visant à obtenir l'autorisation d'exercer une profession réglementée doit être achevée dans les plus brefs délais et, en principe, dans les trois mois à compter de la présentation du dossier complet de l'intéressé8(*).
· Si la procédure de reconnaissance des qualifications professionnelles dans l'Union européenne apparaît encore perfectible, elle est toutefois fréquemment utilisée par les professionnels de santé.
Dans un rapport d'audit récent, la Cour des comptes européenne relève ainsi que 6 % seulement des citoyens européens s'installant dans un autre État membre ont recours à la procédure de reconnaissance des qualifications professionnelles portée par la directive de 2005.
La Cour souligne, par ailleurs, plusieurs faiblesses dans la mise en oeuvre du dispositif, tenant au manque de procédures électroniques, aux frais de reconnaissance inégaux imposés par les États membres, à des demandes de documents excédant les exigences de la directive dans certains États et aux dépassements observés du délai maximal d'examen des dossiers9(*).
Les professions de santé figurent, toutefois, parmi les professions réglementées ayant le plus recours à la procédure. D'après la Cour des comptes européenne, les sept professions bénéficiant d'un régime de reconnaissance automatique sur la base de conditions minimales de formation concentreraient ainsi, à elles seules, 33 % des décisions de reconnaissance recensées depuis 201610(*). Les infirmiers, les médecins et les masseurs-kinésithérapeutes figurent parmi les cinq professions concentrant le plus grand nombre de décisions de reconnaissance entre 2017 et 202111(*).
Les dix professions ayant fait l'objet du plus grand nombre de décisions de reconnaissance des qualifications professionnelles entre 2017 et 2021
Source : commission des affaires sociales, d'après des données de la Cour des comptes européenne (2024)
2. Les conditions attachées à la reconnaissance des qualifications professionnelles des infirmiers roumains
· Le droit européen fixe les conditions minimales de formation dans lesquelles, comme cinq autres professions du secteur de la santé et les architectes, les infirmiers peuvent bénéficier d'une reconnaissance automatique de leurs qualifications professionnelles.
La directive de 2005 prévoit ainsi, d'abord, que la formation d'infirmier responsable de soins généraux doit comprendre au moins trois années d'études ou 4 600 heures d'enseignement théorique et clinique, la durée de l'enseignement théorique devant représenter au moins un tiers et celle de l'enseignement clinique au moins la moitié de la durée minimale de formation.
La formation doit, par ailleurs, donner la garantie que l'intéressé a acquis des connaissances et compétences listées par la directive. Figurent parmi celles-ci :
- une connaissance suffisante de l'organisme, des fonctions physiologiques et du comportement des personnes en bonne santé et des personnes malades ;
- une expérience clinique adéquate, acquise sous le contrôle d'un personnel infirmier qualifié ;
- une expérience de la collaboration avec d'autres professionnels de santé ;
- la capacité d'assurer, de façon indépendante, la qualité des soins infirmiers et leur évaluation12(*).
· Plusieurs exceptions aux exigences minimales sont, toutefois, prévues par la directive.
D'abord, ces exigences ne font pas obstacle aux droits acquis tirés par un ressortissant d'un État membre d'une qualification professionnelle qui, sans répondre aux exigences prévues, permet à son titulaire d'y exercer la profession. Cette exception s'applique, en particulier, dans le cas où l'État membre d'origine relève le niveau de formation requis pour l'accès à une profession mais permet aux titulaires des titres de formation antérieurs de continuer à l'exercer13(*).
La directive de 2005 relative aux qualifications professionnelles a ainsi permis la reconnaissance des titres de formation roumains obtenus avant l'adhésion de la Roumanie à l'Union européenne, qui ne répondaient pas aux exigences minimales fixées, lorsque ceux-ci étaient accompagnés d'un certificat déclarant que ces personnes avaient effectivement et légalement exercé en Roumanie pendant une période d'au moins cinq années consécutives au cours des sept années précédant la date de délivrance du certificat14(*). Une directive de 2013 a réduit la période d'exercice requise à au moins trois années consécutives au cours des cinq ans précédant la date de délivrance du certificat15(*).
Une directive de 2024, enfin, complète la directive de 2005 pour ouvrir le bénéfice de la reconnaissance automatique aux infirmiers attestant de la réalisation d'un programme spécial de mise à niveau permettant aux diplômés roumains de satisfaire aux exigences minimales européennes en matière de formation16(*). Ce programme de mise à niveau, mis en place par la Roumanie entre 2014 et 2019, aurait, d'après le ministère roumain de l'éducation et de la recherche, bénéficié à 23 diplômés de l'enseignement supérieur et plus de 3 000 diplômés de l'enseignement postsecondaire17(*).
· Le droit français a été progressivement adapté au cadre fixé par les directives européennes.
Le code de la santé publique permet, ainsi, l'exercice de la profession d'infirmier aux titulaires du diplôme français d'État d'infirmier et, lorsqu'ils sont ressortissants d'un État membre de l'Union européenne ou d'un État partie à l'accord sur l'Espace économique européen, aux titulaires d'un titre de formation d'infirmier responsable de soins généraux délivré par l'un de ces États conformément aux obligations communautaires18(*).
Depuis l'entrée en vigueur d'une ordonnance de 2017 relative à la reconnaissance des qualifications professionnelles dans le domaine de la santé19(*), le code de la santé publique permet également, en application de la directive de 2013, l'exercice de la profession d'infirmier aux titulaires d'un titre de formation d'infirmier responsable de soins généraux délivré par la Roumanie et non conforme aux obligations communautaires, s'il est accompagné d'une attestation certifiant que l'intéressé a exercé dans cet État, de façon effective et licite, les activités d'infirmier de soins généraux pendant au moins trois années consécutives au cours des cinq années précédant la date de l'attestation20(*).
Les bénéficiaires de la reconnaissance automatique de qualification sont tenus de se faire enregistrer auprès du conseil départemental de l'ordre des infirmiers, qui vérifie les pièces justificatives attestant de leur identité, de leur titre de formation ou de leur autorisation. L'exercice de la profession d'infirmier nécessite l'inscription au tableau de l'ordre. La liste des professionnels inscrits à ce tableau est portée à la connaissance du public21(*).
B. Le dispositif proposé : l'ouverture de la reconnaissance automatique aux infirmiers formés en Roumanie ayant suivi le programme spécial de mise à niveau
L'article 40 du présent projet de loi vise à tirer les conséquences de la directive de 2024 permettant la reconnaissance automatique des qualifications des infirmiers formés en Roumanie ayant suivi le programme spécial de mise à niveau mis en place par cet État membre entre 2014 et 2019.
Pour ce faire, il modifie l'article L. 4311-3 du code de la santé publique, relatif aux titres de formation exigés pour l'exercice en France de la profession d'infirmier.
Le 1° de l'article supprime, au e du 2° de l'article L. 4311-3 du code de la santé publique, la référence aux titres de formation roumains, désormais entièrement régis par le g du même 2°.
Le 2° de l'article réécrit l'actuel g du 2° de l'article L. 4311-3, pour permettre l'exercice de la profession d'infirmier aux titulaires d'un titre de formation délivré par la Roumanie et non conforme aux obligations communautaires :
- non plus seulement si ce titre est accompagné d'une attestation certifiant que l'intéressé a exercé en Roumanie, de façon effective et licite, les activités d'infirmier de soins généraux pendant au moins trois années consécutives au cours des cinq années précédant la date de l'attestation ;
- mais également si l'intéressé est titulaire d'un titre de formation sanctionnant le suivi d'un programme de mise à niveau.
La définition de la liste des titres de formation visés est renvoyée à un arrêté du ministre chargé de la santé.
La directive de février 2024 doit être transposée par les États membres, au plus tard, le 4 mars 202522(*). Saisi de ces dispositions, le Conseil d'État a estimé qu'elles n'appelaient pas d'observations particulières de sa part23(*).
II - Les modifications adoptées par l'Assemblée nationale
En commission de l'aménagement du territoire et du développement durable, l'article 40 a fait l'objet de deux amendements rédactionnels du rapporteur, Vincent Thiébaut.
L'Assemblée nationale a adopté cet article ainsi modifié.
III - La position de la commission
La commission a favorablement accueilli ces dispositions.
· Elle souligne l'intérêt, pour les systèmes de santé nationaux, d'une mobilité facilitée des professionnels au sein de l'Union européenne. Elle observe, à ce titre que les infirmiers et les médecins figurent parmi les professions ayant le plus fréquemment recours à la procédure de reconnaissance automatique des qualifications professionnelles mise en place au sein de l'Union européenne depuis le milieu des années 2000.
Interrogée sur la qualité du programme de mise à niveau mis en place, la direction générale de l'offre de soins (DGOS) confirme que celui-ci « permet aux infirmiers formés en Roumanie de s'aligner sur les exigences françaises, facilitant ainsi leur intégration dans le système de santé français ». Selon elle, ce programme « garantit une qualité de soins optimale tout en ouvrant des perspectives de carrière internationale »24(*).
À cet égard, la commission relève que la Cour des comptes européenne a récemment constaté la persistance de faiblesses importantes dans la procédure de reconnaissance des qualifications, et appelle à faciliter le parcours des professionnels concernés.
· La commission souligne que la profession infirmière connaît des tensions démographiques importantes, que le présent article ne contribuera toutefois que très marginalement à résoudre.
Si le nombre d'infirmiers en emploi augmente - il a crû de 8 % entre 2013 et 2021 pour s'établir, à cette date, à 600 000 en France -, ce dynamisme ne permettra pas de répondre à la hausse des besoins liée à l'augmentation et au vieillissement de la population. La direction de la recherche, des études, de l'évaluation et des statistiques (Drees) des ministères sociaux a ainsi estimé, dans une publication récente, qu'au rythme actuel de progression des effectifs, 80 000 infirmiers supplémentaires seraient nécessaires en 2050 pour assurer la même couverture de besoins en soins qu'actuellement25(*).
Le nombre d'infirmiers formés en Roumanie exerçant en France demeure, lui, relativement faible en comparaison à l'effectif de la profession. Interrogée par le rapporteur, la DGOS estime que 684 infirmiers détenteurs d'un diplôme roumain sont actuellement inscrits au tableau de l'ordre des infirmiers26(*).
Malgré ce constat, les dispositions du présent article apparaissent souhaitables pour favoriser l'exercice en France d'infirmiers formés en Roumanie et nécessaires pour adapter le code de la santé publique aux évolutions du droit européen. En conséquence, la commission propose leur adoption, sous réserve d'un amendement rédactionnel COM-88 de son rapporteur.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article ainsi modifié.
Article 41
Approvisionnement en dispositifs médicaux et
dispositifs médicaux de diagnostic in vitro
Cet article vise à adapter le droit national au nouveau dispositif européen de déclaration des interruptions et cessations d'approvisionnement en dispositifs médicaux et dispositifs médicaux de diagnostic in vitro, ainsi qu'à confier à l'Agence nationale de sécurité du médicament et des produits de santé des prérogatives de police sanitaire destinées à permettre la continuité des prises en charge en période de tension.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article modifié par deux amendements rédactionnels et de coordination.
I - Le dispositif proposé
A. L'enjeu de sécurisation de l'approvisionnement en dispositifs médicaux et sa prise en compte croissante par les droits français et européens
1. L'encadrement européen des dispositifs médicaux et les difficultés d'approvisionnement observées
· Les dispositifs médicaux et dispositifs médicaux de diagnostic in vitro font l'objet d'un encadrement européen, récemment renouvelé.
Le règlement (UE) n° 2017/745 relatif aux dispositifs médicaux (DM) définit ces derniers comme « tout instrument, appareil, équipement, logiciel, implant, réactif, matière ou autre article » destiné à être utilisé chez l'homme pour une ou plusieurs fins médicales et dont l'action principale voulue dans ou sur le corps humain n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme27(*).
Le règlement (UE) n° 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro (DMDIV) définit ces derniers comme « tout dispositif médical qui consiste en un réactif, un produit réactif, un matériau d'étalonnage, un matériau de contrôle, une trousse, un instrument, un appareil, un équipement, un logiciel ou un système (...) destiné par le fabricant à être utilisé in vitro dans l'examen d'échantillons provenant du corps humain »28(*).
Ces deux règlements ont visé à améliorer la sécurité des DM et DMDIV en étendant, notamment, les obligations :
- des fabricants, exploitants et distributeurs ;
- des organismes certifiés, chargés notamment de d'octroyer les marquages « CE » attestant de la conformité des dispositifs à la réglementation européenne et permettant leur commercialisation sur le marché européen.
Les règlements de 2017 ont également cherché à améliorer l'information des parties prenantes et la traçabilité des dispositifs, par la création d'une nouvelle base de données européenne Eudamed rassemblant les informations relatives aux DM et DMDIV commercialisés en Europe29(*).
L'obligation faite aux dispositifs précédemment certifiés d'obtenir un nouveau marquage CE, attestant de leur conformité aux exigences européennes, a suscité de vives inquiétudes chez l'ensemble des parties prenantes. La commission des affaires sociales observait qu'en octobre 2022, « près de 23 000 certificats de conformité aux anciennes directives européennes apparaissaient encore devoir être remplacés, laissant craindre que des dispositifs médicaux ne puissent plus être commercialisés ou que certains fabricants renoncent à leur certification »30(*).
Pour tenir compte de ces difficultés, la période transitoire au cours de laquelle un dispositif peut être commercialisé, sous certaines conditions, sans avoir encore obtenu un nouveau marquage CE a été plusieurs fois allongée, jusqu'au 31 décembre 2027 pour certaines catégories de dispositifs présentant un niveau élevé de risque, et jusqu'au 31 décembre 202831(*) ou 202932(*) pour les autres.
· Les difficultés associées au renouvellement des marquages CE contribuent à alimenter les craintes relatives à l'approvisionnement en DM et DMDIV.
En France, l'Agence nationale de sécurité des médicaments et des produits de santé (ANSM) indique constater un nombre croissant de ruptures ces dernières années, qu'elle attribue à « l'évolution des exigences réglementaires qui a notamment impliqué une restructuration du marché », au contexte géopolitique mondial et à son effet sur la disponibilité des matières premières, comme à diverses difficultés industrielles33(*).
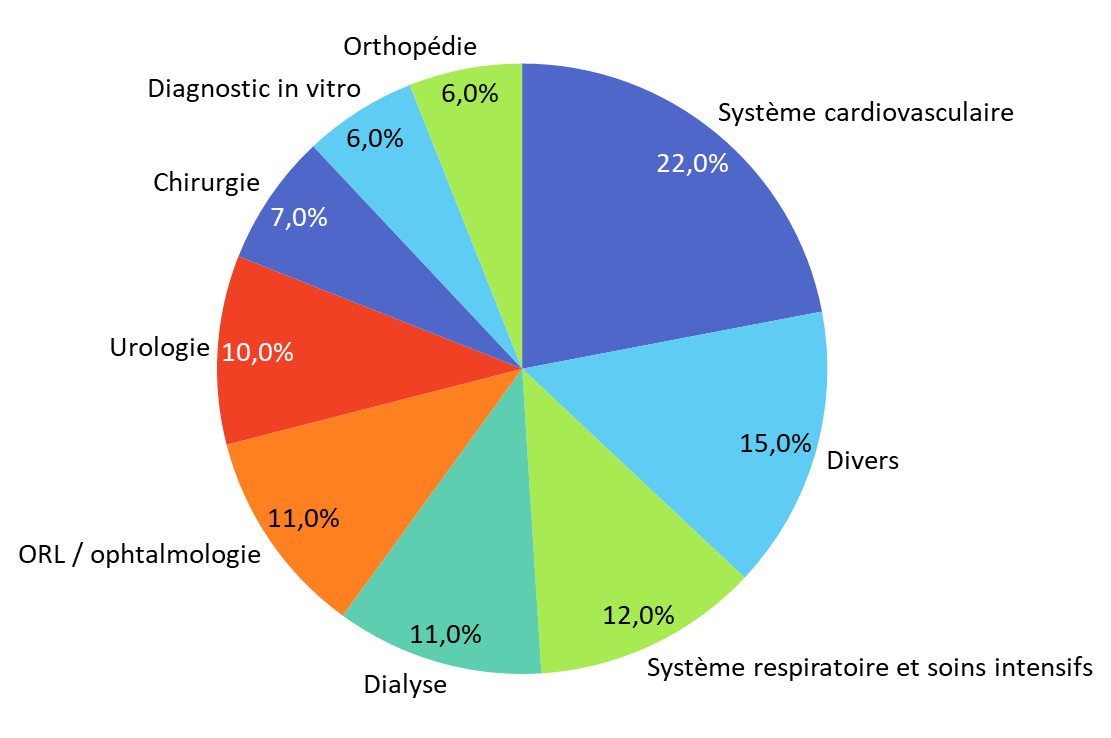
Ces signalements, fournis volontairement par les exploitants, les syndicats professionnels, les sociétés savantes ou les professionnels de santé, concerneraient une grande diversité de fabricants - multinationales, petites et moyennes entreprises, très petites entreprises - de catégories de dispositifs et d'aires thérapeutiques. Leur nombre aurait sensiblement augmenté ces dernières années, passant de 104 en 2022 à 149 en 2024.
Répartition des signalements réalisés en 2024 par aire thérapeutique
Source : commission des affaires sociales du Sénat, d'après des données transmises par l'ANSM
2. La prise en compte croissante des enjeux d'approvisionnement en France et en Europe
a) La mise en place de procédures de déclaration et de gestion des ruptures en France depuis 2021
Pour répondre aux ruptures observées et aux enjeux sanitaires associés, des procédures de sécurisation de l'approvisionnement en DM et DMDIV ont été mises en place, en France, ces dernières années.
· L'Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié en 2021, d'abord, une procédure de gestion anticipée des ruptures et risques de ruptures dans la disponibilité des DM et DMDIV dits « indispensables », dont l'indisponibilité entraînerait une situation de risque dans la prise en charge du patient34(*).
Mise à jour en septembre 202435(*), cette procédure vise notamment à permettre :
- l'évaluation par les opérateurs, sur la base d'une grille d'analyse des risques, de la criticité de tensions, de ruptures d'approvisionnement ou d'arrêts de commercialisation ;
- la gestion préventive par l'opérateur, en lien avec les utilisateurs et les acheteurs, des effets des tensions, ruptures ou arrêts de commercialisation identifiés ;
- l'intervention de l'ANSM, enfin, lorsque les actions mises en oeuvre ne suffisent pas à maîtriser les risques identifiés.
· En outre, le législateur a introduit dans le code de la santé publique en 202336(*) des procédures de déclaration à l'ANSM et de gestion de l'indisponibilité d'un DM ou d'un DMDIV.
Celles-ci font obligation aux fabricants, importateurs ou distributeurs qui identifient un risque de suspension ou de cessation de commercialisation d'un DM ou DMDIV indispensable, de mettre en oeuvre les mesures nécessaires pour éviter sa réalisation et, dans le cas où celles-ci se révèleraient insuffisantes, d'informer l'ANSM de l'existence de ce risque, sous peine de sanction financière. L'ANSM peut intervenir directement en cas en cas d'absence de déclaration et de mesures, ou lorsque ces dernières se révèlent insuffisantes37(*).
Toutefois, aucun des actes réglementaires nécessaires à leur application n'ayant été pris, ces dispositions sont demeurées inappliquées. Pour l'expliquer, le Gouvernement a mis en avant, dans le cadre du contrôle sénatorial de l'application des lois, les risques d'incompatibilité avec les évolutions récentes du droit de l'Union européenne en matière d'approvisionnement en DM et DMDIV38(*).
· Enfin, la loi de financement de la sécurité sociale (LFSS) pour 202539(*) crée un nouveau chapitre au sein du code de la santé publique relatif à la lutte contre les ruptures d'approvisionnement en dispositifs médicaux et porte des dispositions visant à permettre l'identification et la prise en charge de dispositifs médicaux alternatifs en cas de rupture.
Celles-ci permettent aux ministres chargés de la santé et de la sécurité sociale, lorsque l'interruption ou la cessation attendue de la fourniture d'un DM ou DMDIV est susceptible d'entraîner un préjudice grave ou un risque de préjudice grave pour les patients ou la santé publique, de déterminer par arrêté, pris sur proposition de l'ANSM, les dispositifs médicaux alternatifs et les conditions dérogatoires de leur prise en charge par l'assurance maladie40(*).
b) Les développements récents du dispositif européen Eudamed
Un règlement européen de juin 202441(*) a complété les règlements de 2017 relatifs aux DM et DMDIV pour y insérer de nouvelles dispositions relatives aux obligations de déclaration des opérateurs en cas d'interruption ou de cessation de la fourniture de certains dispositifs.
· Ce nouveau dispositif, permettant l'alimentation de la base de données Eudamed, fait obligation aux fabricants de DM ou DMDIV qui anticipent une interruption ou une cessation d'approvisionnement, lorsqu'il est raisonnablement prévisible que cette interruption ou cessation pourrait entraîner un préjudice grave ou un risque de préjudice grave pour les patients ou la santé publique dans un ou plusieurs États membres, d'informer :
- l'autorité compétente de l'État membre dans lequel ils sont établis ;
- les opérateurs économiques, les établissements de santé et professionnels de santé auxquels ils fournissent directement les dispositifs concernés.
Cette information doit être communiquée, sauf circonstances exceptionnelles, au moins six mois avant l'interruption ou la cessation attendue et préciser ses motifs.
· Les règlements européens relatifs aux DM et DMDIV font également, désormais, obligation :
- à l'autorité compétente qui a reçu l'information, d'informer sans retard injustifié les autorités compétentes des autres États membres et la Commission ;
- aux opérateurs économiques qui ont reçu l'information, d'informer sans retard injustifié tout autre opérateur économique, les établissements de santé et les professionnels de santé auxquels ils fournissent directement les dispositifs concernés42(*).
L'objectif affiché de ce nouveau dispositif est de permettre aux autorités compétentes et aux établissements de santé « de prendre des mesures d'atténuation si nécessaire afin de garantir la santé et la sécurité des patients »43(*).
B. Le dispositif proposé : l'adaptation du droit national au nouveau dispositif déclaratif européen
L'article 41 du présent projet de loi vise à tirer les conséquences, en droit interne, du dispositif déclaratif porté par le règlement européen 2024/1860 de juin 2024.
· Pour ce faire, les 1° et 3° du I réécrivent les articles L. 5211-5-1 et L. 5221-7 du code de la santé publique, qui portaient les dispositions relatives à la procédure de déclaration et de gestion des indisponibilités des DM et DMDIV adoptées par le Parlement en 2023 et demeurées inappliquées.
Désormais, ces articles prévoiraient que, lorsqu'elle est informée conformément à l'obligation européenne de l'interruption ou de la cessation attendue de la fourniture d'un DM ou d'un DMDIV, et lorsqu'elle estime que cette interruption ou cessation est susceptible d'entraîner un préjudice grave ou un risque de préjudice grave pour les patients ou la santé publique, l'ANSM prend les mesures strictement nécessaires et proportionnées afin d'assurer la continuité de la prise en charge de l'état de santé des patients.
Les dispositions précisent que, dans de telles circonstances, l'ANSM :
- publie sur son site internet les informations relatives aux interruptions ou cessations de fourniture des dispositifs concernés ;
- peut émettre des recommandations comportant notamment des solutions alternatives et des mesures d'information et d'accompagnement des professionnels et des patients, ces recommandations étant, le cas échéant, publiées sur le site internet de l'agence ;
- peut soumettre à des conditions particulières, restreindre ou suspendre l'exploitation, l'exportation, la distribution en gros, le conditionnement, la mise sur le marché à titre gratuit ou onéreux, la détention en vue de la vente ou la distribution à titre gratuit, la publicité, la mise en service, la prescription, la délivrance ou l'utilisation du dispositif concerné.
Il doit être mis fin sans délai à ces mesures lorsqu'elles cessent d'être nécessaires pour assurer la continuité de la prise en charge de l'état de santé des patients.
Afin de permettre l'évaluation des effets de l'interruption ou de la cessation attendue et des mesures nécessaires à la continuité de la prise en charge, ainsi que la mise en oeuvre des mesures prises à ce titre, le fabricant ou son mandataire doit communiquer à l'ANSM les informations qu'elle sollicite.
L'étude d'impact jointe au présent projet de loi précise que, sur le modèle du médicament, ces dispositions permettront notamment à l'ANSM d'imposer aux fabricants l'organisation d'un contingentement qualitatif ou quantitatif, permettant de restreindre l'utilisation d'un dispositif médical à l'une de ses indications, aux patients les plus à risque, à certains professionnels de santé ou établissements44(*).
· Les 2° et 4° du I de l'article 41 complètent les articles L. 5211-6 et L. 5221-8 du code de la santé publique pour prévoir qu'en matière, respectivement, de DM et de DMDIV, des décrets en Conseil d'État pourront déterminer :
- les modalités d'information de l'ANSM, des opérateurs économiques, des établissements de santé et des professionnels de santé en application des règlements européens relatifs aux DM et DMDIV modifiés ;
- les modalités de définition, après une procédure contradictoire adaptée aux circonstances, des mesures que l'ANSM estime nécessaires à la continuité de la prise en charge et des conditions de leur mise en oeuvre, ainsi que les règles applicables à la transmission des informations demandées par l'ANSM au fabricant ou au mandataire d'un DM ou d'un DMDIV.
· Les 5° et 6° du I modifient et complètent les articles L. 5461-9 et L. 5462-8 du code de la santé publique pour soumettre à sanctions financières :
- le fait, pour le fabricant d'un DM ou d'un DMDIV établi en France ou dont le mandataire est établi en France, de ne pas informer dans les conditions prévues par les règlements européens de l'interruption ou de la cessation attendue de la fourniture d'un dispositif l'ANSM, ainsi que les opérateurs économiques, les établissements de santé et les professionnels de santé auxquels il fournit directement le dispositif concerné ;
- le fait, pour le fabricant d'un DM ou d'un DMDIV établi en France ou dont le mandataire est établi en France, de ne pas respecter les mesures prises par l'ANSM pour assurer la continuité de la prise en charge ou de ne pas répondre aux demandes d'informations qu'elle lui adresse ;
- le fait, pour les opérateurs économiques informés par le fabricant, son mandataire ou tout autre opérateur économique de l'interruption ou de la cessation attendue de la fourniture d'un DM ou d'un DMDIV, de ne pas en informer les autres opérateurs économiques, les établissements de santé et les professionnels de santé auxquels ils fournissent directement le dispositif conformément aux règlements européens.
· Le 7° du I de l'article 41 modifie l'article L. 5471-1 du code de la santé publique, fixant les montants maximaux des sanctions financières que l'ANSM peut prononcer, pour soumettre les manquements précités à une sanction maximale de 150 000 € pour une personne physique et 50 % du chiffre d'affaires réalisé lors du dernier exercice clos pour le dispositif concerné, dans la limite de cinq millions d'euros, pour une personne morale.
L'ANSM pourra également décider de publier les décisions de sanction financière prononcées à ce titre sur son site internet.
· Les 8° et 9° du I modifient les articles L. 5522-1 et L. 5524-1 du code de la santé publique pour rendre les dispositions portées par le présent article applicables à Wallis-et-Futuna.
· Enfin, le II de l'article 41 prévoit que celui-ci entre en vigueur le 10 janvier 2025.
Les obligations déclaratives portées par le règlement européen de 2024 sont, en effet, applicables à compter de cette date45(*).
II - Les modifications adoptées par l'Assemblée nationale
· En commission de l'aménagement du territoire et du développement durable, l'article 41 a fait l'objet de deux amendements rédactionnels du rapporteur, Vincent Thiébaut.
Un amendement du rapporteur, supprimant les dispositions du II qui fixaient la date d'entrée en vigueur du dispositif au 10 janvier 2025, a, par ailleurs, été adopté compte tenu des délais d'examen parlementaire constatés.
· En séance plénière, l'Assemblée nationale a adopté un amendement rédactionnel du rapporteur.
L'Assemblée nationale a adopté cet article ainsi modifié.
III - La position de la commission
La commission a favorablement accueilli les dispositions du présent article.
· Elle observe, d'abord, que celui-ci transpose correctement en droit interne les dispositions du règlement européen de 2024 instaurant des obligations de déclaration à destination des fabricants de DM et DMDIV et des opérateurs économiques, lorsqu'une interruption ou une cessation prévisible d'approvisionnement risque d'entraîner un préjudice grave pour les patients ou la santé publique.
Le Conseil d'État estime ainsi, dans son avis publié sur le présent projet de loi, que les dispositions relatives aux sanctions portées par l'article 41 se bornent à tirer les conséquences nécessaires du règlement européen et n'appellent, à ce titre, aucune observation de sa part46(*).
· La commission a, en outre, soutenu les dispositions du présent article permettant à l'ANSM de prendre des mesures de police sanitaire nécessaires à la continuité des prises en charge en période de tension d'approvisionnement.
La commission s'est, plusieurs fois, montrée attachée à une meilleure anticipation et à une meilleure gestion des difficultés d'approvisionnement observées dans le secteur des DM et DMDIV. Observant que « contrairement aux médicaments, aucune disposition du code de la santé publique ne permet de lutter efficacement contre les phénomènes de rupture de DM et DMDIV », elle avait porté, en 2023, l'amendement à l'origine des dispositions instaurant une nouvelle procédure de déclaration et de gestion de l'indisponibilité d'un dispositif47(*).
La commission juge que le présent article, qui remplace les dispositions adoptées en 2023 et demeurées inappliquées par de nouvelles dispositions, adaptées au règlement européen de 2024, poursuit de manière satisfaisante le même objectif.
Elle observe, au surplus, que le Conseil d'État, dans son avis consultatif précité, a jugé que les dispositions confiant de nouvelles prérogatives à l'ANSM relevaient bien de la compétence des autorités nationales « pour organiser, en complément du dispositif de l'Union européenne, un régime de police administrative spéciale afin de prévenir les conséquences à l'égard des patients et de la santé publique d'une pénurie de dispositifs médicaux et notamment d'assurer la continuité de la prise en charge de l'état de santé des patients. »48(*)
Enfin, le rapporteur relève que les représentants du secteur, auditionnés, ont jugé les nouvelles prérogatives confiées à l'ANSM utiles en période de tension d'approvisionnement49(*).
Tenant compte de l'ensemble de ces éléments, la commission propose d'adopter les présentes dispositions sous réserve d'un amendement COM-89 de coordination juridique et d'un amendement rédactionnel COM-90 de son rapporteur.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter cet article ainsi modifié.
EXAMEN EN COMMISSION
Réunie le mardi 4 mars 2025, sous la présidence de M. Philippe Mouiller, président, la commission examine le rapport de M. Khalifé Khalifé rapporteur, sur le projet de loi (n° 352, 2024-2025) portant diverses dispositions d'adaptation au droit de l'Union européenne en matière économique, financière, environnementale, énergétique, de transport, de santé et de circulation des personnes.
M. Philippe Mouiller, président. - Notre ordre du jour appelle l'examen de l'avis de notre commission sur le projet de loi, adopté par l'Assemblée nationale après engagement de la procédure accélérée, portant diverses dispositions d'adaptation au droit de l'Union européenne en matière économique, financière, environnementale, énergétique, de transport, de santé et de circulation des personnes.
Je précise que la commission de l'aménagement du territoire et du développement durable, saisie au fond, nous a délégué l'examen des articles 40 et 41. Cela signifie qu'au moment d'établir le texte, elle s'en remettra à notre avis et à nos éventuels amendements pour les articles en question, sans les instruire au fond.
Ce projet de loi sera examiné en séance les 10 et 11 mars. Dans la même logique, nous nous réunirons pour examiner les amendements relatifs aux articles délégués à notre commission, s'il y en a, le 10 mars en début d'après-midi.
Je donne sans attendre la parole à notre rapporteur pour avis, Khalifé Khalifé.
M. Khalifé Khalifé, rapporteur pour avis. - Le projet de loi portant diverses dispositions d'adaptation au droit de l'Union européenne en matière économique, financière, environnementale, énergétique, de transport, de santé et de circulation des personnes qui nous réunit cet après-midi est, comme son intitulé le laisse pressentir, un texte large et composite.
Le projet de loi porte 44 articles touchant à divers champs de notre droit national. Tous sont présentés par le Gouvernement comme nécessaires pour mettre notre droit en conformité avec le droit de l'Union européenne ou tirer les conséquences, dans la loi, d'évolutions normatives intervenues au niveau européen.
Deux de ces articles concernent la santé : l'article 40 porte sur les conditions de reconnaissance des qualifications professionnelles des infirmiers formés en Roumanie ; l'article 41 sur l'approvisionnement en dispositifs médicaux. La commission de l'aménagement du territoire et du développement durable en a délégué l'examen au fond à notre commission.
Commençons, si vous le voulez bien, par l'article 40 relatif à la reconnaissance des diplômes roumains d'infirmier.
Il faut d'abord rappeler que la reconnaissance des qualifications constitue le corollaire des principes de libre circulation des travailleurs à l'intérieur de l'Union européenne et de liberté d'établissement pour les activités non salariées. Ces principes sont consacrés par les traités européens et nécessaires à l'instauration d'un marché unique.
En conséquence, une directive européenne de 2005 a instauré deux régimes de reconnaissance des qualifications professionnelles au sein de l'Union, bénéficiant aux ressortissants des États membres.
D'une part, le régime général permet l'exercice d'une profession réglementée dans l'Union aux personnes titulaires d'un diplôme décerné par l'un des États membres et autorisant, dans cet État, l'accès à cette même profession, sous réserve de mesures de compensation en cas d'écart substantiel entre la formation de l'intéressé et la formation exigée dans le pays d'accueil.
D'autre part, la directive de 2005 établit pour certaines professions un régime de reconnaissance automatique, plus favorable aux diplômés puisque n'impliquant pas de comparaison de leurs qualifications avec les exigences nationales du pays d'accueil. Ce régime est notamment applicable à sept professions, pour lesquelles la directive fixe des conditions minimales de formation : les infirmiers, les médecins, les sages-femmes, les chirurgiens-dentistes, les pharmaciens, les vétérinaires et les architectes.
Les professions de santé bénéficiant du régime de reconnaissance automatique figurent parmi les professions réglementées ayant le plus recours à cette procédure. D'après la Cour des comptes européenne, entre 2017 et 2021, plus de 25 000 infirmiers et plus de 25 000 médecins auraient bénéficié d'une reconnaissance des qualifications.
Venons-en maintenant aux conditions spécifiques de reconnaissance des diplômes infirmiers délivrés par la Roumanie.
Lors de l'intégration de cet État à l'Union européenne - je rappelle que la demande d'intégration, formulée en 1995, a été actée en 2005, pour une application en 2007 -, la formation des infirmiers ne respectait pas les exigences portées par la directive de 2005. Celle-ci prévoit, notamment, des durées minimales de formation théorique et pratique, donnant la garantie que l'étudiant dispose d'une expérience clinique adéquate et soit capable d'assurer la qualité des soins infirmiers de manière indépendante.
Toutefois, la directive européenne a prévu une exception, permettant aux titulaires de diplômes roumains obtenus avant l'adhésion de la Roumanie à l'Union européenne de bénéficier de la reconnaissance automatique des qualifications, lorsque ces diplômes sont accompagnés d'un certificat attestant de l'expérience professionnelle de l'intéressé. L'expérience requise a été abaissée par une directive de 2013, ramenant la durée de formation à trois ans, au lieu de cinq initialement.
Ces règles ont été transposées dans le code de la santé publique, qui confie à l'ordre des infirmiers le soin de contrôler les demandes de reconnaissance.
Une directive de 2024, enfin, a de nouveau assoupli ce régime en permettant la reconnaissance des diplômes roumains ne satisfaisant pas aux exigences européennes, lorsque ces derniers sont accompagnés d'un titre de formation sanctionnant la réalisation d'un programme spécial de mise à niveau. Ce programme, mis en place par la Roumanie entre 2014 et 2019, aurait bénéficié à plus de 3 000 diplômés.
L'article 40 qui nous est soumis vise à transposer cette dernière évolution en droit national. Je vous proposerai de le soutenir, sous réserve d'un amendement rédactionnel, dans la mesure où il est nécessaire pour mettre notre droit en conformité avec celui de l'Union européenne, et souhaitable compte tenu de la qualité reconnue du programme de remise à niveau.
Il est de l'intérêt de notre système de santé de faciliter la mobilité en France des professionnels formés au sein de l'Union européenne. Leur nombre demeure aujourd'hui modeste : 3 % seulement des infirmiers exerçant en France ont été formés à l'étranger et, selon le ministère, 684 infirmiers titulaires d'un diplôme roumain seraient inscrits au tableau de l'ordre.
Le second article qui nous est soumis vise à sécuriser l'approvisionnement en dispositifs médicaux.
Selon l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), que j'ai auditionnée, le nombre de signalements de ruptures de dispositifs médicaux et de dispositifs médicaux de diagnostic in vitro a considérablement augmenté au cours des dernières années. Alors que l'ANSM recensait 104 signalements en 2022, elle en a reçu 149 en 2024.
Les tensions constatées toucheraient une grande diversité de dispositifs et seraient multifactorielles. D'après l'Agence, l'ensemble des aires thérapeutiques sont concernées. Parmi les signalements reçus, 37 % seraient dus à des difficultés d'approvisionnement et 28 % à un arrêt de commercialisation.
Il faut rappeler, à cet égard, que les règlements européens de 2017 ont profondément renouvelé le cadre juridique applicable au secteur et imposé aux exploitants d'obtenir un nouveau « marquage CE » pour chacun de leurs dispositifs, destiné à démontrer leur conformité. Notre commission a plusieurs fois relayé les craintes d'engorgement mises en avant par les entreprises et le risque que certaines d'entre elles renoncent à la commercialisation de dispositifs dans l'Union européenne compte tenu des coûts associés.
En réponse à ces difficultés, la France et l'Union européenne ont progressivement mis en place des outils de sécurisation de l'approvisionnement en dispositifs médicaux au cours des dernières années.
L'ANSM a établi, depuis 2021, une procédure de gestion anticipée des ruptures, impliquant les opérateurs dans l'évaluation et la maîtrise des risques associés.
Sur l'initiative de notre commission, le législateur a fait obligation en 2023, aux exploitants identifiant un risque, d'agir pour éviter sa réalisation et d'informer l'ANSM, sous peine de sanction financière. En l'absence de décret d'application, ces dispositions sont toutefois restées inappliquées.
La loi de financement de la sécurité sociale pour 2025 a récemment porté des dispositions visant à permettre l'identification et la prise en charge de dispositifs alternatifs en cas de rupture.
Enfin, un règlement européen de 2024 fait obligation aux fabricants anticipant une interruption ou une cessation d'approvisionnement, susceptible d'entraîner un préjudice grave pour les patients ou la santé publique, d'informer l'autorité nationale compétente, ainsi que les opérateurs économiques, les établissements et les professionnels de santé auxquels ils fournissent directement le dispositif concerné.
L'article 41 tire les conséquences de ce règlement en droit national en soumettant à des sanctions financières les fabricants qui ne respecteraient pas leurs obligations déclaratives. Il permet en outre à l'ANSM de prendre, dans de telles circonstances, des mesures de police sanitaire nécessaires et proportionnées afin d'assurer la continuité des prises en charge.
L'Agence devrait publier sur son site internet les informations relatives à l'interruption ou à la cessation d'approvisionnement. Elle pourrait également émettre des recommandations à destination des professionnels et des patients, et soumettre à des conditions particulières, restreindre ou suspendre l'exploitation, l'exportation, la distribution, le conditionnement, la mise sur le marché, la détention, la publicité, la mise en service, la prescription, la délivrance ou l'utilisation d'un dispositif.
Cet article, nécessaire pour assurer l'application du règlement européen de 2024, permettrait donc également de confier à l'ANSM des outils de lutte contre les pénuries de dispositifs médicaux proches de ceux dont elle dispose dans le secteur des médicaments. Cette évolution correspond à une proposition ancienne de notre commission. C'est pourquoi je vous proposerai de soutenir l'article, sous réserve de deux amendements rédactionnels et de coordination juridique.
Vous l'aurez compris, mes chers collègues, les deux articles qui nous sont soumis, de portée inégale, me semblent faire oeuvre utile pour notre système de santé. Toutes les organisations que j'ai auditionnées ont confirmé leur pertinence. Dans ces conditions, je vous proposerai de les adopter sans modification de fond.
Il me revient enfin de vous proposer un périmètre pour l'application des irrecevabilités au titre de l'article 45 de la Constitution.
Pour les dispositions relevant du champ de compétence de notre commission, je considère que ce périmètre comprend les dispositions d'adaptation au droit de l'Union européenne relatives à la reconnaissance des qualifications professionnelles au sein de l'Union et à l'approvisionnement en dispositifs médicaux.
Mme Émilienne Poumirol. - Je ferai deux remarques très brèves sur ce texte large et fourre-tout, dont on ne comprend pas très bien le fonctionnement.
Tout d'abord, il apporte une belle reconnaissance pour les infirmiers, et c'est, me semble-t-il, une marque d'humilité bienvenue que d'admettre que nous ne sommes pas les seuls à savoir en former. Mais je regrette que ce même principe ne s'applique pas aux médecins, qu'ils soient formés en Roumanie, en Belgique ou ailleurs. Nous avons pu constater, lors d'une visite en Roumanie, que les étudiants en médecine avaient toutes les difficultés du monde à venir exercer en France ; même à la fin de leurs études, il est plus simple pour eux d'aller faire l'internat en Suisse ou en Allemagne que dans notre pays. Je regrette que ce sujet n'ait pas été évoqué.
Par ailleurs, l'ANSM a de plus en plus de dossiers à suivre, de plus en plus de sanctions à prendre. Les moyens évoluent-ils en conséquence ? Comment l'Agence pourra-t-elle remplir toutes ses missions sans cela ?
M. Khalifé Khalifé, rapporteur pour avis. - Nous sommes d'accord sur le constat, ma chère collègue, mais la question des médecins formés en Roumanie n'entre pas dans le cadre de ce texte. On connaît les difficultés qu'ils rencontrent, notamment pour ce qui concerne la psychiatrie. Je pense que nous reviendrons sur ce sujet important, lorsque nous entamerons la deuxième phase de notre « marathon » sur les études médicales, qui concernera la suite des études. Ajoutons qu'il existe déjà des dispositions pour les médecins roumains et que certains points ayant trait à la qualité des formations méritent d'être revus, non pas tant sur le plan de la théorie que sur celui de la pratique. J'en veux pour preuve que certains étudiants essaient de quitter la Roumanie pour s'inscrire en quatrième année en France. Le système n'est donc pas tout à fait satisfaisant.
Si vous me permettez, monsieur le président, je profite de cette réponse pour évoquer un rapport du ministère de l'agriculture sur la formation des vétérinaires, faisant remonter des cas de figure similaires : les restrictions en Belgique conduisent de nombreux étudiants à partir pour la Roumanie, l'Espagne ou ailleurs. Seuls 7 % ont réellement choisi de partir à l'étranger ; les autres n'ont pas eu le choix. C'est donc tout le système qui mérite d'être revu, et c'est notre rôle d'alerter le Gouvernement sur la situation.
EXAMEN DES ARTICLES
Article 40 (délégué)
L'amendement rédactionnel COM-88 est adopté.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter l'article 40 ainsi modifié.
M. Khalifé Khalifé, rapporteur pour avis. - L'amendement COM-89 est un amendement de coordination juridique visant à insérer les dispositions relatives aux prérogatives de police administrative spéciale de l'Agence nationale de sécurité du médicament et des produits de santé dans le nouveau chapitre du code de la santé publique relatif à la lutte contre les ruptures d'approvisionnement en dispositifs médicaux. Je profite de sa présentation pour répondre à la question relative à une éventuelle surcharge de l'ANSM. Lors des auditions, nous n'avons pas senti de malaise de la part de ses représentants sur les évolutions envisagées. Nous pourrons en savoir plus à l'occasion du prochain conseil d'administration, au sein duquel nous sommes plusieurs sénateurs à siéger.
L'amendement COM-89 est adopté.
L'amendement rédactionnel COM-90 est adopté.
La commission propose à la commission de l'aménagement du territoire et du développement durable d'adopter l'article 41 ainsi modifié.
M. Philippe Mouiller, président. - Nous en venons à l'amendement COM-16 de Mme Imbert, qui concerne l'inscription à l'ordre des pharmaciens exerçant la fonction de personne qualifiée responsable dans des entreprises de médicaments vétérinaires et, à ce titre, nous semble sortir du périmètre du texte.
Mme Florence Lassarade. - Tous les vétérinaires font de la parapharmacie...
Mme Émilienne Poumirol. - Cet amendement a déjà eu une histoire à l'Assemblée nationale...
M. Philippe Mouiller, président. - Tout à fait. Il a été adopté en commission et supprimé en séance publique. Pour ce qui nous concerne, il nous apparaît irrecevable au regard du périmètre du texte que nous examinons.
M. Khalifé Khalifé, rapporteur pour avis. - Il y a néanmoins un sujet, suscitant un malaise important. C'est une question qu'il faudra examiner.
La commission propose à la commission de l'aménagement du territoire et du développement durable de déclarer l'amendement COM-16 irrecevable en application de l'article 45 de la Constitution.
M. Philippe Mouiller, président. - Nous transmettrons l'ensemble de nos propositions à la commission de l'aménagement du territoire et du développement durable afin qu'elle les intègre à son texte.
TABLEAU DES AVIS
|
Auteur |
N° |
Objet |
Avis de la commission |
|
|
Article 40 |
||||
|
M. KHALIFÉ, rapporteur pour avis |
COM-88 |
Amendement rédactionnel |
Adopté |
|
|
Article 41 |
||||
|
M. KHALIFÉ, rapporteur pour avis |
COM-89 |
Amendement de coordination juridique |
Adopté |
|
|
M. KHALIFÉ, rapporteur pour avis |
COM-90 |
Amendement rédactionnel |
Adopté |
|
|
Article additionnel après l'article 41 |
||||
|
Mme IMBERT |
COM-16 |
Inscription à l'ordre des pharmaciens exerçant la fonction de personne qualifiée responsable au sein d'une entreprise de médicaments vétérinaires |
Irrecevable au titre de l'article 45 de la Constitution |
|
RÈGLES RELATIVES À L'APPLICATION DE L'ARTICLE
45
DE LA CONSTITUTION ET DE L'ARTICLE 44 BIS
DU RÈGLEMENT DU
SÉNAT (« CAVALIERS »)
Si le premier alinéa de l'article 45 de la Constitution, depuis la révision du 23 juillet 2008, dispose que « tout amendement est recevable en première lecture dès lors qu'il présente un lien, même indirect, avec le texte déposé ou transmis », le Conseil constitutionnel estime que cette mention a eu pour effet de consolider, dans la Constitution, sa jurisprudence antérieure, reposant en particulier sur « la nécessité pour un amendement de ne pas être dépourvu de tout lien avec l'objet du texte déposé sur le bureau de la première assemblée saisie »50(*).
De jurisprudence constante et en dépit de la mention du texte « transmis » dans la Constitution, le Conseil constitutionnel apprécie ainsi l'existence du lien par rapport au contenu précis des dispositions du texte initial, déposé sur le bureau de la première assemblée saisie51(*).
Pour les lois ordinaires, le seul critère d'analyse est le lien matériel entre le texte initial et l'amendement, la modification de l'intitulé au cours de la navette restant sans effet sur la présence de « cavaliers » dans le texte52(*). Pour les lois organiques, le Conseil constitutionnel ajoute un second critère : il considère comme un « cavalier » toute disposition organique prise sur un fondement constitutionnel différent de celui sur lequel a été pris le texte initial53(*).
En application des articles 17 bis et 44 bis du Règlement du Sénat, il revient à la commission saisie au fond de se prononcer sur les irrecevabilités résultant de l'article 45 de la Constitution, étant précisé que le Conseil constitutionnel les soulève d'office lorsqu'il est saisi d'un texte de loi avant sa promulgation.
En application du vade-mecum sur l'application des irrecevabilités au titre de l'article 45 de la Constitution, adopté par la Conférence des Présidents, la commission des affaires sociales a arrêté, lors de sa réunion du mardi 4 mars 2025, le périmètre indicatif des articles du projet de loi n° 352 (2024-2025) portant diverses dispositions d'adaptation au droit de l'Union européenne en matière économique, financière, environnementale, énergétique, de transport, de santé et de circulation des personnes.
Elle a considéré que ce périmètre incluait, au titre des articles dont l'examen lui a été délégué par la commission de l'aménagement du territoire et du développement durable, des dispositions relatives :
- à la reconnaissance des qualifications professionnelles au sein de l'Union ;
- à l'approvisionnement en dispositifs médicaux.
LISTE DES PERSONNES ENTENDUES
· Conseil national de l'ordre des infirmiers (CNOI)
Mabrouk Nekka, trésorier adjoint
Maxime Abdou, juriste
· Agence nationale de sécurité du médicament et des produits de santé (ANSM)
Alexandre de la Volpilière, directeur général adjoint en charge des opérations
Gwenaëlle Even, directrice adjointe de la direction médicale
José Da Silva, chef du pôle juridique et droits des usagers
· Syndicat national de l'industrie des technologies médicales (Snitem)
Cécile Vaugelade, spécialiste affaires publiques
Alexandra Leurs, directeur affaires gouvernementales
· Syndicat de l'industrie du diagnostic in vitro (Sidiv)
Caroline Boulvin, directrice générale
· Direction générale de l'offre de soins (DGOS)
Carole Stenger, adjointe au chef du bureau de l'exercice et de la déontologie
· Direction générale de la santé (DGS)
Esther Lepaicheux, cheffe du bureau dispositifs médicaux et autres produits de santé
Mélanie Cailleret, adjointe d'Esther Lepaicheux
· Direction des affaires juridiques des ministères sociaux (DAJMS)
Pauline Berne, sous-directrice de la législation, direction des affaires juridiques
LA LOI EN CONSTRUCTION
Pour naviguer dans les rédactions successives du texte, visualiser les apports de chaque assemblée, comprendre les impacts sur le droit en vigueur, le tableau synoptique de la loi en construction est disponible sur le site du Sénat à l'adresse suivante :
https://www.senat.fr/dossier-legislatif/pjl24-352.html
* 1 Article 45 du traité sur le fonctionnement de l'Union européenne.
* 2 Article 49 du traité sur le fonctionnement de l'Union européenne.
* 3 Article 1er de la directive 2005/36/CE du Parlement européen et du Conseil du 7 septembre 2005 relative à la reconnaissance des qualifications professionnelles.
* 4 Article 13 de la directive 2005/36/CE précitée.
* 5 Article 14 de la directive 2005/36/CE précitée.
* 6 Articles 16 et suivants de la directive 2005/36/CE précitée.
* 7 Article 21 de la directive 2005/36/CE précitée.
* 8 Article 51 de la directive 2005/36/CE précitée.
* 9 Cour des comptes européenne, Reconnaissance des qualifications professionnelles dans l'Union européenne. Un mécanisme essentiel, mais utilisé de manière sporadique et incohérente, 2024.
* 10 Ibid., p. 12.
* 11 Ibid., p. 10.
* 12 Article 31 de la directive 2005/36/CE précitée.
* 13 Article 12 de la directive 2005/36/CE précitée.
* 14 Article 33 bis de la directive 2005/36/CE précitée, dans sa version en vigueur au 1er janvier 2007.
* 15 Directive 2013/55/UE du Parlement européen et du Conseil du 20 novembre 2013 modifiant la directive 2005/36/CE relative à la reconnaissance des qualifications professionnelles.
* 16 Directive 2024/505/UE du Parlement européen et du Conseil du 7 février 2024 modifiant la directive 2005/36/CE en ce qui concerne la reconnaissance des qualifications professionnelles des infirmiers responsables de soins généraux formés en Roumanie.
* 17 Données citées par l'étude d'impact jointe au présent projet de loi, p. 571.
* 18 Article L. 4311-3 du code de la santé publique.
* 19 Ordonnance n° 2017-50 du 19 janvier 2017 relative à la reconnaissance des qualifications professionnelles dans le domaine de la santé.
* 20 Article L. 4311-3 du code de la santé publique.
* 21 Article L. 4311-15 et D. 4311-95 du code de la santé publique.
* 22 Article 2 de la directive 2024/505/UE précitée.
* 23 Avis consultatif du Conseil d'État du 4 novembre 2024 sur le présent projet de loi.
* 24 Réponses écrites de la DGOS au questionnaire transmis par le rapporteur.
* 25 Drees, Le nombre d'infirmières augmenterait fortement d'ici à 2050, mais moins que les besoins en soins de la population vieillissante, décembre 2024.
* 26 Réponses écrites de la DGOS au questionnaire transmis par le rapporteur.
* 27 Article 2 du règlement (UE) 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux, modifiant la directive 2001/83/CE, le règlement (CE) n° 178/2002 et le règlement (CE) n° 1223/2009.
* 28 Article 2 du règlement (UE) 2017/746 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux de diagnostic in vitro et abrogeant la directive 98/79/CE et la décision 2010/227/UE de la Commission.
* 29 Articles 33 du règlement (UE) 2017/745 et 30 du règlement (UE) 2017/746 précités.
* 30 Pascale Gruny, rapport n° 186 (2022-2023) sur le projet de loi portant diverses dispositions d'adaptation au droit de l'Union européenne dans les domaines de l'économie, de la santé, du travail, des transports et de l'agriculture, 7 décembre 2022, p. 81.
* 31 Règlement (UE) 2023/607 du Parlement européen et du Conseil du 15 mars 2023 modifiant les règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne les dispositions transitoires relatives à certains dispositifs médicaux et à certains dispositifs médicaux de diagnostic in vitro.
* 32 Règlement (UE) 2024/1860 du Parlement européen et du Conseil du 13 juin 2024 modifiant les règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne un déploiement progressif d'Eudamed, l'obligation d'informer en cas d'interruption ou de cessation d'approvisionnement et les dispositions transitoires applicables à certains dispositifs médicaux de diagnostic in vitro.
* 33 Réponses écrites de l'ANSM au questionnaire transmis par le rapporteur.
* 34 Communiqué de l'ANSM « Indisponibilité d'un dispositif médical : l'ANSM publie une procédure de gestion préventive pour les opérateurs du marché » publié le 4 août 2021.
* 35 Communiqué de l'ANSM « Déclarer l'indisponibilité d'un dispositif médical : la procédure évolue » publié le 5 juillet 2024.
* 36 Article 27 de la loi n° 2023-171 du 9 mars 2023 portant diverses dispositions d'adaptation au droit de l'Union européenne dans les domaines de l'économie, de la santé, du travail, des transports et de l'agriculture.
* 37 Articles L. 5211-5-1 et L. 5221-7 du code de la santé publique.
* 38 Sylvie Vermeillet, rapport d'information n° 624 (2023-2024) sur le bilan annuel de l'application des lois au 31 mars 2024, déposé le 22 mai 2024, p. 266.
* 39 Article 75 de la loi n° 2025-199 du 28 février 2025 de financement de la sécurité sociale pour 2025.
* 40 Article L. 5215-1 du code de la santé publique.
* 41 Règlement (UE) 2024/1860 du Parlement européen et du Conseil du 13 juin 2024 modifiant les règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne un déploiement progressif d'Eudamed, l'obligation d'informer en cas d'interruption ou de cessation d'approvisionnement et les dispositions transitoires applicables à certains dispositifs médicaux de diagnostic in vitro.
* 42 Articles 10 bis des règlements (UE) 2017/745 et 2017/746 précités.
* 43 Considérant n° 15 du règlement (UE) 2024/1860 précité.
* 44 Étude d'impact jointe au présent projet de loi, p. 580.
* 45 Article 3 du règlement (UE) 2024/1860 précité.
* 46 Avis consultatif du Conseil d'État sur le présent projet de loi.
* 47 Amendement COM-11 de Mme Gruny, rapporteur, adopté par la commission des affaires sociales du Sénat le 6 décembre 2022 dans le cadre de l'examen du projet de loi n° 140 (2022-2023) portant diverses dispositions d'adaptation au droit de l'Union européenne dans les domaines de l'économie, de la santé, du travail, des transports et de l'agriculture.
* 48 Avis consultatif du Conseil d'État sur le présent projet de loi.
* 49 Réponses écrites du Snitem et du Sidiv au questionnaire transmis par le rapporteur.
* 50 Cf. commentaire de la décision n° 2010-617 DC du 9 novembre 2010 - Loi portant réforme des retraites.
* 51 Cf. par exemple les décisions n° 2015-719 DC du 13 août 2015 - Loi portant adaptation de la procédure pénale au droit de l'Union européenne et n° 2016-738 DC du 10 novembre 2016 - Loi visant à renforcer la liberté, l'indépendance et le pluralisme des médias.
* 52 Décision n° 2007-546 DC du 25 janvier 2007 - Loi ratifiant l'ordonnance n° 2005-1040 du 26 août 2005 relative à l'organisation de certaines professions de santé et à la répression de l'usurpation de titres et de l'exercice illégal de ces professions et modifiant le code de la santé publique.
* 53 Décision n° 2020-802 DC du 30 juillet 2020 - Loi organique portant report de l'élection de six sénateurs représentant les Français établis hors de France et des élections partielles pour les députés et les sénateurs représentant les Français établis hors de France.