Rapport n° 307 (2009-2010) de M. Jean-Pierre DOOR, député et Mme Marie-Christine BLANDIN , sénatrice, fait au nom de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, déposé le 19 février 2010
Disponible au format Acrobat (920 Koctets)
-
SAISINE
-
INTRODUCTION
-
PREMIERE PARTIE : L'INQUIÉTUDE
CAUSÉE PAR L'APPARITION D'UN VIRUS MUTANT
-
DEUXIÈME PARTIE : LA RÉPONSE DES
POUVOIRS PUBLICS
-
I. LE PROCESSUS DÉCISIONNEL
-
A - LE RÔLE MAJEUR DE L'OMS DANS LA
DÉFINITION D'UNE PANDÉMIE
-
B - EN EUROPE, DEUX ORGANISMES JOUENT UN
ROLE PARTICULIER
-
C - EN FRANCE, LA GESTION DE LA
PANDÉMIE RELÈVE D'UN PILOTAGE INTERMINISTÉRIEL
RELATIVEMENT COMPLEXE
-
A - LE RÔLE MAJEUR DE L'OMS DANS LA
DÉFINITION D'UNE PANDÉMIE
-
II - L'EVALUATION DE LA SITUATION :
LE RÔLE DE LA VEILLE ET DE LA SURVEILLANCE SANITAIRES
-
III - LA MISE EN PLACE D'UNE POLITIQUE DE
PRÉVENTION
-
A - LES ÉTAPES NÉCESSAIRES
À LA PRÉPARATION D'UN NOUVEAU VACCIN
-
B. LES COMMANDES PUBLIQUES
-
C - LA MISE EN PLACE DE LA VACCINATION
-
A - LES ÉTAPES NÉCESSAIRES
À LA PRÉPARATION D'UN NOUVEAU VACCIN
-
IV - L'APPLICATION DE CETTE POLITIQUE DANS
L'OUTRE-MER FRANÇAIS
-
A - LA SITUATION À LA
RÉUNION
-
1. La gestion de la crise a relevé du
Préfet
-
2. La veille et la surveillance sanitaires se sont
déroulées comme en métropole.
-
3. Comme en métropole, les soins ont
été organisés en deux phases, mais ont concerné
plus de personnes
-
4. La vaccination est organisée depuis
octobre de la même façon qu'en métropole.
-
5. Les leçons que tirent les
Réunionnais de l'ensemble de cette période sont
particulièrement intéressantes.
-
1. La gestion de la crise a relevé du
Préfet
-
B - LA SITUATION EN GUYANE
-
A - LA SITUATION À LA
RÉUNION
-
I. LE PROCESSUS DÉCISIONNEL
-
TROISIEME PARTIE : LA NECESSAIRE PRISE EN
COMPTE D'INTERROGATIONS LEGITIMES
-
I - LES TECHNIQUES DE FABRICATION DES
VACCINS GARANTISSENT-ELLES LEUR FIABILITE ?
-
II. L'INFORMATION DISPONIBLE SUR LES VACCINS
EST-ELLE SUFFISANTE ?
-
III. PEUT-ON SE PASSER DES ADJUVANTS ET DES
CONSERVATEURS ?
-
IV. FAUT-IL CRAINDRE LE SYNDROME DE GUILLAIN
BARRE ?
-
V. FALLAIT-IL PASSER DES COMMANDES AUSSI
IMPORTANTES ?
-
I - LES TECHNIQUES DE FABRICATION DES
VACCINS GARANTISSENT-ELLES LEUR FIABILITE ?
-
QUATRIEME PARTIE : LA GESTION SOCIETALE D'UNE
CRISE SANITAIRE DONT L'AMPLEUR ETAIT INCONNUE : VERS UNE NOUVELLE APPROCHE
DE LA POLITIQUE DE SANTE PUBLIQUE ET DU DEBAT PUBLIC
-
I. EVALUER SEREINEMENT LA PREMIERE EXPERIENCE DE
LUTTE CONTRE UNE PANDEMIE
-
A - LES MESURES PRISES LORS DE LA
PREMIÈRE ÉTAPE N'ONT PAS ÉTÉ, A L'ÉPOQUE,
CRITIQUÉES
-
B. LA DEUXIÈME PHASE DEVRA ÊTRE
ANALYSÉE AVEC SOIN
-
C. LE RETOUR À LA NORMALE FOURNIT
L'OCCASION DE DRESSER UN BILAN ET DE PRENDRE DES DISPOSITIONS POUR
L'AVENIR
-
1. Le retour à des modes de gestion
habituels est survenu peu de temps après le franchissement du pic de
pandémie
-
2. C'est aussi le temps du bilan et des
interrogations sur la nature des choix effectués
-
a) Les comparaisons internationales
suggèrent que l'éventail des solutions possibles était
très large
-
b) Ne faudrait-il pas préciser le plan
pandémie, et envisager des phases intermédiaires moins
drastiques ?
-
c) N'aurait-il pas fallu confier un
rôle plus important au ministère de la Santé dans le
pilotage de la crise ?
-
a) Les comparaisons internationales
suggèrent que l'éventail des solutions possibles était
très large
-
1. Le retour à des modes de gestion
habituels est survenu peu de temps après le franchissement du pic de
pandémie
-
A - LES MESURES PRISES LORS DE LA
PREMIÈRE ÉTAPE N'ONT PAS ÉTÉ, A L'ÉPOQUE,
CRITIQUÉES
-
II. GARANTIR LA TRANSPARENCE DES DECISIONS ET DE
LA GOUVERNANCE DE LA CRISE
-
A. LE DEBAT SUR LA TRANSPARENCE DES CONTRATS
PASSES ENTRE L'ETAT ET LES LABORATOIRES PHARMACEUTIQUES
-
B. LE DÉBAT SUR LES CONFLITS
D'INTÉRÊTS ÉVENTUELS DES EXPERTS EMPLOYÉS PAR LES
DÉCIDEURS.
-
A. LE DEBAT SUR LA TRANSPARENCE DES CONTRATS
PASSES ENTRE L'ETAT ET LES LABORATOIRES PHARMACEUTIQUES
-
III - S'INTERROGER SUR L'ACCEPTABILITE
DES CHOIX DE SANTE PUBLIQUE
-
A - LA SOCIÉTÉ A
ÉVOLUÉ DANS SES ATTENTES ET SA MANIÈRE DE
COMMUNIQUER
-
B - LES MODES DE GESTION PUBLIQUE ET DE
COMMUNICATION INSTITUTIONNELLE DOIVENT S'ADAPTER À CETTE
ÉVOLUTION
-
C. L'ORGANISATION DE DEBATS CITOYENS PERMETTRAIT
DE MIEUX DEFINIR CE QUE DEVRAIT ÊTRE LA POLITIQUE DE SANTÉ
PUBLIQUE
-
A - LA SOCIÉTÉ A
ÉVOLUÉ DANS SES ATTENTES ET SA MANIÈRE DE
COMMUNIQUER
-
I. EVALUER SEREINEMENT LA PREMIERE EXPERIENCE DE
LUTTE CONTRE UNE PANDEMIE
-
CINQUIEME PARTIE : L'ACTION DES INSTITUTS DE
RECHERCHE
-
SIXIEME PARTIE: LA SITUATION AUX ETATS-UNIS
-
I. LA RÉPARTITION DES COMPÉTENCES
ENTRE LA FÉDÉRATION ET LES ETATS FÉDÉRÉS
OBLIGE LES ORGANES FÉDÉRAUX DES ETATS-UNIS À FAIRE PREUVE
DE CONVICTION ET DE PERSUASION
-
A - LE ROLE DE L'ETAT FEDERAL EST PAR DEFINITION
LIMITE
-
B - LES DECLARATIONS DU PRESIDENT DES
ETATS-UNIS ONT ESSENTIELLEMENT UN EFFET MEDIATIQUE OU PUREMENT ADMINISTRATIF.
-
C - L'ETAT FEDERAL S'APPUIE NEANMOINS SUR UN
RESEAU D'INSTITUTIONS EXTREMEMENT PUISSANT
-
D - L'ORGANISATION DE LA CHAINE DE
COMMANDEMENT EST ESSENTIELLE
-
E - LES ORGANES FEDERAUX DOIVENT CONVAINCRE
LES ETATS ET LES COMTES DE LA PERTINENCE DE LEURS RECOMMANDATIONS ET DE LEURS
ACTIONS.
-
A - LE ROLE DE L'ETAT FEDERAL EST PAR DEFINITION
LIMITE
-
II - LA COMMUNICATION EST UN ÉLÉMENT
FONDAMENTAL DE L'EFFICACITÉ DE CE SYSTÈME
-
III - LA DYNAMIQUE DE LA PANDÉMIE N'A PAS
ÉTÉ SEMBLABLE AUX ETATS-UNIS ET EN FRANCE, MAIS LE CONTEXTE DANS
LEQUEL LES POUVOIRS PUBLICS ONT DU PRENDRE DES DÉCISIONS EST TRÈS
PROCHE
-
A - LA PANDÉMIE A ETE BEAUCOUP PLUS
PRÉCOCE, ET S'EST DÉJÀ DÉVELOPPÉE EN DEUX
VAGUES
-
B - LE PRECEDENT DE LA GRIPPE AVIAIRE A JOUE
UN ROLE CONSIDERABLE DANS LE PROCESSUS DECISIONNEL
-
C - LES DECISIONS FONDAMENTALES DES POUVOIRS
PUBLICS ONT ETE PRISES DANS LE MEME CLIMAT D'INCERTITUDE QU'EN FRANCE.
-
D - IL EST INDISPENSABLE D'ETABLIR
L'HISTORIQUE DES DECISIONS ET DE LES REPLACER DANS LEUR CONTEXTE TEMPOREL POUR
EVALUER LEUR PERTINENCE
-
E - LES FINANCEMENTS MIS EN OEUVRE AU NIVEAU
NATIONAL SONT PRESQUE SEMBLABLES QUAND ON LES RAPPORTE A L'IMPORTANCE RELATIVE
DES DEUX POPULATIONS
-
F - UNE MISE A DISPOSITION DES VACCINS PLUS
TARDIVE QUE PREVU
-
A - LA PANDÉMIE A ETE BEAUCOUP PLUS
PRÉCOCE, ET S'EST DÉJÀ DÉVELOPPÉE EN DEUX
VAGUES
-
IV. PLUSIEURS CHOIX SEMBLABLES ONT
ÉTÉ FAITS DANS LA GESTION DE LA MALADIE
-
V LE CHOIX DES VACCINS A RÉPONDU À
D'AUTRES CRITÈRES QU'EN FRANCE.
-
A - LE CHOIX FONDAMENTAL DE VACCINS SANS
ADJUVANTS
-
B - LES ETATS-UNIS N'ONT CEPENDANT PAS DE
PREVENTION SANITAIRE A PRIORI CONTRE LES ADJUVANTS.
-
C - LES ETATS-UNIS ONT EN FAIT CONTACTE LES
PRODUCTEURS DE VACCIN AVEC QUI ILS TRAVAILLENT REGULIEREMENT LORS DE LA GRIPPE
SAISONNIERE.
-
D - LES PRODUITS SERVANT A FABRIQUER LES
VACCINS ONT ÉTÉ STOCKES EN VRAC, CE QUI PERMET DE LES CONSERVER
PLUS LONGTEMPS, OU DE PRÉVOIR LEUR RÉUTILISATION EN PLURIVALENTS,
ET D'ÉVITER DE LES REVENDRE
-
E - UN VACCIN EN SPRAY CONNAIT UN SUCCES
IMPORTANT
-
A - LE CHOIX FONDAMENTAL DE VACCINS SANS
ADJUVANTS
-
VI - DES MODES DE VACCINATION BEAUCOUP PLUS
DIVERS
-
VII. LA RECHERCHE DE NOUVEAUX VACCINS ET DE
NOUVEAUX MÉDICAMENTS ANTIVIRAUX : ESPOIRS ET
RÉALITÉS
-
A - L'ESPOIR D'UN VACCIN UNIVERSEL,
PLURIVALENT, VALABLE PLUSIEURS ANNEES
-
B - LA CULTURE CELLULAIRE EST DE PLUS EN PLUS
ETUDIEE EN COMPLEMENT DE LA CULTURE SUR OEUFS
-
C - LA RECHERCHE DE NOUVEAUX VACCINS ET DE
NOUVEAUX ANTI-VIRAUX
-
D - LA MISE AU POINT DE TESTS PLUS RAPIDES,
TOUT EN PRESERVANT LEUR FIABILITE
-
A - L'ESPOIR D'UN VACCIN UNIVERSEL,
PLURIVALENT, VALABLE PLUSIEURS ANNEES
-
VIII - L'EXPÉRIENCE FRANÇAISE
EST ÉTUDIÉE AVEC INTÉRÊT
-
A - LES PRÉOCCUPATIONS DES MEDIA SONT
DE PLUS EN PLUS SEMBLABLES, DU FAIT DE LA RAPIDITÉ DE TRANSMISSION DES
INFORMATIONS
-
B - L'EXISTENCE DE CHOIX DIFFÉRENTS
DONNE PLUS DE LATITUDE A UN ETAT POUR DÉCIDER D'INFLEXIONS DE SA
POLITIQUE SI LE CONTEXTE ÉVOLUAIT
-
C - DES COOPÉRATIONS INSTITUTIONNELLES
EXISTENT ENTRE FRANÇAIS ET AMÉRICAINS
-
A - LES PRÉOCCUPATIONS DES MEDIA SONT
DE PLUS EN PLUS SEMBLABLES, DU FAIT DE LA RAPIDITÉ DE TRANSMISSION DES
INFORMATIONS
-
IX - LES FRANÇAIS AUX ETATS-UNIS ET LA
VACCINATION
-
X. CONCLUSIONS PARTIELLES
-
I. LA RÉPARTITION DES COMPÉTENCES
ENTRE LA FÉDÉRATION ET LES ETATS FÉDÉRÉS
OBLIGE LES ORGANES FÉDÉRAUX DES ETATS-UNIS À FAIRE PREUVE
DE CONVICTION ET DE PERSUASION
-
CONCLUSION GENERALE
|
N° 2314 ASSEMBLÉE NATIONALE CONSTITUTION DU 4 OCTOBRE 1958 TREIZIÈME LÉGISLATURE |
N° 307 SÉNAT SESSION ORDINAIRE DE 2009-2010 |
|
Enregistré à la Présidence de l'Assemblée nationale |
Enregistré à la Présidence du Sénat |
|
Le 19 février 2010 |
le 19 février 2010 |
________________________
OFFICE PARLEMENTAIRE D'ÉVALUATION
DES CHOIX SCIENTIFIQUES ET TECHNOLOGIQUES
_______________________
RAPPORT D'ÉTAPE
Mutation des virus et gestion des pandémies
L'exemple du virus A(H1N1)
Par M. Jean-Pierre Door, Député, et
Mme Marie-Christine Blandin, Sénatrice
__________ __________
Déposé sur le Bureau de l'Assemblée nationale Déposé sur le Bureau du Sénat
par M. Claude BIRRAUX, par M. Jean-Claude ÉTIENNE,
Président de l'Office Premier Vice-Président de l'Office
_________________________________________________________________________
COMPOSITION
de l'Office parlementaire
d'évaluation
des choix scientifiques et technologiques
Président
M. Claude BIRRAUX
Premier Vice-Président
M. Jean-Claude ÉTIENNE
Vice-Présidents
M. Claude GATIGNOL, député Mme Brigitte BOUT, sénatrice
M. Pierre LASBORDES, député M. Christian GAUDIN, sénateur
M. Jean-Yves LE DÉAUT, député M. Daniel RAOUL, sénateur
|
D ÉPUTÉS |
SÉNATEURS |
|
M. Christian BATAILLE M. Claude BIRRAUX M. Jean-Pierre BRARD M. Alain CLAEYS M. Pierre COHEN M. Jean-Pierre DOOR Mme Geneviève FIORASO M. Claude GATIGNOL M. Alain GEST M. François GOULARD M. Christian KERT M. Pierre LASBORDES M. Jean-Yves LE DÉAUT M. Michel LEJEUNE M. Claude LETEURTRE Mme Bérengère POLETTI M. Jean-Louis TOURAINE M. Jean-Sébastien VIALATTE |
M. Gilbert BARBIER M. Paul BLANC Mme Marie-Christine BLANDIN Mme Brigitte BOUT M. Marcel-Pierre CLÉACH M. Roland COURTEAU M. Marc DAUNIS M. Marcel DENEUX M. Jean-Claude ÉTIENNE M. Christian GAUDIN M. Serge LAGAUCHE M. Jean-Marc PASTOR M. Xavier PINTAT Mme Catherine PROCACCIA M. Daniel RAOUL M. Ivan RENAR M. Bruno SIDO M. Alain VASSELLE |
SAISINE

INTRODUCTION
L'Office parlementaire d'évaluation des choix scientifiques et technologiques a été saisi, le 2 juin 2009, d'une demande d'étude sur la mutation des virus émanant de la commission des affaires culturelles, familiales et sociales de l'Assemblée nationale, avant sa division en deux nouvelles commissions.
La lettre de saisine précisait que « cette étude, dont l'intérêt parait certain, compte tenu de l'apparition d'un nouveau type de grippe dit A/H1N1, complèterait utilement les travaux conduits sous la précédente législature sur le risque épidémique et sur la grippe aviaire » .
A la suite de cette saisine, l'Office a désigné deux rapporteurs, M. Jean-Pierre Door, député, et Mme Marie-Christine Blandin, sénatrice, lors de sa réunion du 8 juillet 2009. Les deux rapporteurs ont alors procédé à une étude de faisabilité.
Ils ont tout d'abord examiné les précédents rapports parlementaires établis sur des sujets connexes :
- le rapport de M. Jean-Pierre Door et Mme Marie-Christine Blandin sur le risque épidémique, réalisé en 2005, dans le cadre de l'Office parlementaire d'évaluation des choix scientifiques et technologiques ;
- le rapport de MM. Jean-Marie Le Guen et Jean-Pierre Door sur le thème : « Menace de pandémie grippale : préparer les moyens médicaux » , réalisé en 2006 dans le cadre de la mission d'information de l'Assemblée nationale sur la grippe aviaire : mesures préventives.
Ils ont ensuite recherché les sources d'information disponibles, particulièrement nombreuses sur Internet, ce qui leur a permis de dresser une première liste des acteurs concernés par cette question, et d'élaborer plusieurs pistes de recherche.
Le 13 octobre 2009, ils ont présenté leur étude de faisabilité à l'OPECST qui l'a approuvée et a décidé que leur étude porterait sur « la mutation des virus et la gestion des pandémies ».
A l'issue de cette étude, les rapporteurs ont constitué un comité de pilotage composé de :
- M. le Professeur François BRICAIRE, Chef du service des maladies infectieuses et tropicales de l'hôpital de la Pitié-Salpêtrière à Paris ;
- M. le Professeur Jean-François DELFRAISSY, Directeur de l'Institut Microbiologie et Maladies infectieuses (IMMI), INSERM ;
- M. le Professeur Antoine FLAHAUT, Directeur de l'Ecole des hautes études en santé publique (EHESP) ;
- M. Claude LE PEN, Professeur de sciences économiques à l'Université de Paris-Dauphine ;
- M. le Professeur Bruno LINA, Directeur du centre national de référence contre la grippe (CNRG) pour le Sud de la France, délégué général du Groupe d'étude et d'information sur la grippe (GEIG), directeur du laboratoire de virologie et de pathologie humaine à Lyon ;
- M. Jean-Claude MANUGUERRA, Responsable de la Cellule d'Intervention Biologique d'Urgence (CIBU) à l'Institut Pasteur ;
- M. Didier TABUTEAU, Conseiller d'Etat, spécialiste des questions de santé et de sécurité sociale, Directeur général de la Fondation Caisses d'Epargne pour la solidarité et Directeur de la Chaire Santé de l'IEP de Paris.
Plusieurs auditions ont permis de recueillir les témoignages de virologues, de médecins, de chercheurs en santé publique, mais aussi en sciences humaines et sociales.
Le 1er décembre 2009, les rapporteurs ont organisé une audition publique sur le thème : « Face à la grippe A(H1N1) et à la mutation des virus, que peuvent faire chercheurs et pouvoirs publics ? ». Les actes en ont été publiés sous les numéros 2226 à l'Assemblée nationale et 204 au Sénat.
Ils ont effectué deux missions à La Réunion et aux Etats Unis, et eu l'occasion d'avoir des informations de première main sur la Chine et la Guyane.
La campagne de vaccination et la gouvernance de la crise sanitaire ayant suscité diverses critiques, les rapporteurs ont souhaité présenter dès maintenant ce rapport d'étape consacré au virus A(H1N1).
Les rapporteurs aborderont les autres virus dans leur rapport final, ainsi que les problèmes liés à la gestion des pandémies, en s'attachant plus particulièrement à deux virus qui restent potentiellement dangereux, et qui du reste existent en Camargue : le H5N1, virus de la grippe aviaire, et le chikungunia, dont les séquelles sont encore fortes à La Réunion, et dont la gestion de la crise est très instructive.
Ce rapport d'étape retrace l'inquiétude causée par l'apparition d'un virus mutant et analyse la réponse des pouvoirs publics. Il met en évidence combien il est nécessaire de prendre en compte les interrogations légitimes des citoyens et propose une nouvelle approche de la politique de santé publique et du débat public. Il met l'accent sur la nécessité de poursuivre les efforts de recherche. Il analyse enfin la manière dont les Etats-Unis ont fait face à la pandémie actuelle.
PREMIERE PARTIE : L'INQUIÉTUDE CAUSÉE PAR L'APPARITION D'UN VIRUS MUTANT
Cette inquiétude, réelle, a été renforcée par l'incertitude sur les possibilités de réponse médicale.
I - L'APPARITION D'UN NOUVEAU VIRUS QUE L'ON IDENTIFIE RAPIDEMENT, MAIS QUI SUSCITE DE NOMBREUSES CRAINTES
A - UN VIRUS H1N1 D'UN TYPE PARTICULIER
Ce virus H1N1 est un virus de classe A, qui est particulièrement infectieux. On distingue en effet trois types de virus grippaux, les A, les B et les C. Les classes A et B sont à l'origine des épidémies saisonnières. Le virus C est la source de cas sporadiques. Seul le virus A peut causer des pandémies.
Sa structure est connue. Elle comprend une enveloppe, à l'intérieur de laquelle on trouve huit brins d'ARN, dont la taille peut évoluer, et qui vont se répliquer.
Cette enveloppe possède trois protéines membranaires virales majeures : la protéine M2, l'hémagglutinine (dite H), la neuraminidase (dite N). Le H et le N permettent de caractériser les virus de la grippe. On compte en effet 16 formes connues de H et 9 de N. Mais seules 23 associations H-N ont été dénombrées sur la centaine de possibilités théoriques.
Le nouveau virus aurait pu être différent. Les grippes saisonnières humaines sont en effet de type H1, H2 ou H3 associé à N1 ou N2. Elles se distinguent ainsi des autres formes de grippe : les grippes porcines sont H1N1, H1N2 et H3N2. Mais la grippe est essentiellement aviaire, puisque peuvent se manifester 15 sous-types H, de H1 à H15.
Ce virus pandémique A(H1N1) appartient à la famille du virus de la grippe espagnole, dont il est l'un des lointains descendants, ce qui a ravivé beaucoup de souvenirs funestes, même si à l'époque la population était particulièrement fragilisée par la guerre, et qu'il n'existait pas alors d'antibiotiques, de respirateurs, de médicaments antiviraux, et de vaccins adaptés.
On sait par ailleurs que l'attaque des virus se produit généralement en plusieurs vagues. Des pics peuvent être identifiés, ce qui permet de définir la réponse médicale à apporter, tout en sachant qu'on ne peut prédire ni l'éventualité, ni la date d'apparition d'une nouvelle vague.
B - UN VIRUS QUI RAPPELLE LORS DE SON IDENTIFICATION LE VIRUS DE LA GRIPPE AVIAIRE H5N1
Le virus A(H1N1) est un virus grippal que l'on dit mortel, fin avril 2009. Il atteint des personnes habituellement peu concernées par des formes graves de la grippe : il frappe davantage les jeunes que les personnes âgées.
C'est pourquoi il alerte comme le H5N1. Il provient du reste, comme ce dernier, de recombinaisons virales entre virus humains et animaux franchissant la barrière des espèces.
De plus, il est davantage contagieux. On s'aperçoit très vite qu'il se propage rapidement, et que sa diffusion n'épargne aucun continent. Il est donc potentiellement plus dangereux que le H5N1.
C- UN VIRUS QUI SE TRANSMET D'HUMAIN À HUMAIN
Cette distinction est importante.
Il existe en effet deux grands schémas de transmission d'un virus : le virus peut franchir la barrière des espèces et se transmettre de l'animal à l'humain. Puis il peut, sans que ce soit systématique, se transmettre d'humain à humain.
Les virus de la grippe, pour prendre cet exemple, ont souvent une origine aviaire. Ils franchissent une première fois la barrière des espèces en passant d'un oiseau ou d'un canard affecté à un porc, du fait de la promiscuité qui règne la plupart du temps dans les fermes du Sud-Est asiatique. Puis ils passent du porc à l'homme. Ce fut le cas du H5N1. Le A(H1N1), pour sa part, résulte d'une recombinaison de virus d'origine aviaire, porcine et humaine.
La transmission entre êtres humains n'est pas systématique. L'exemple le plus récent en a été fourni par le virus H5N1, transmis de l'animal à l'homme, mais dont on n'a pas prouvé de transmissions entre humains.
Le H1N1 est en revanche fortement contagieux entre humains et se transmet par la voie aérienne ou le toucher d'une personne ou d'un objet infectés. Son pouvoir de contagion est avéré, son degré de dangerosité incertain.
Ses conséquences peuvent être graves, sans qu'on n'arrive à savoir pourquoi ni à en expliquer les causes.
Il touche des populations habituellement non concernées, plus jeunes et n'appartenant à aucun groupe à risque traditionnel. Son mode de transmission reste inconnu. Les personnes âgées sont moins atteintes que lors des grippes saisonnières, mais leur taux de létalité est le même que pour les enfants lorsqu'elles sont atteintes.
Si l'on ne sait pas pourquoi il atteint tel ou tel individu, on sait quelles en sont les conséquences graves : les poumons sont particulièrement touchés.
Cette distinction entre pouvoir de contagion et dangerosité est fondamentale. Elle explique les craintes des scientifiques qui estiment qu'un jour un virus sera à la fois fortement contagieux et très dangereux.
C'est pourquoi de nombreux travaux scientifiques de haut niveau vont être menés, dans des conditions d'extrême sécurité, pour vérifier si le nouveau virus H1N1 est susceptible de muter en se mélangeant avec le H5N1.
II - L'INCERTITUDE SUR LES POSSIBILITES DE REPONSE MEDICALE
Tant que le nouveau vaccin n'est pas disponible, seuls des médicaments antiviraux peuvent être utilisés. Il en découle une organisation des soins plus difficile qu'en cas de grippe saisonnière (pour laquelle on prépare l'élaboration du vaccin dès le mois de février de l'année précédente) et une situation particulière dans l'hémisphère Sud, immédiatement touché.
A - L'INEXISTENCE, QUI DURERA NÉCESSAIREMENT PLUSIEURS MOIS, D'UN VACCIN ADAPTÉ
L'apparition de nouveaux virus de la grippe est banale. La plupart du temps, le nouveau virus qui apparaît dominant et qui va devenir le virus de la grippe saisonnière est assez peu différent des précédents. Les vaccins utilisés jusqu'alors peuvent généralement être réutilisés, surtout s'ils ont été conçus pour être polyvalents, ce que facilite la présence d'adjuvants.
La situation est totalement différente lorsqu' apparaît un virus qui a muté suffisamment pour ne plus être proche des virus habituellement en circulation. Il est alors nécessaire de fabriquer un nouveau vaccin car la probabilité est très élevée que les vaccins habituellement utilisés pour se prémunir de la grippe saisonnière soient inefficaces, malgré leur polyvalence.
L'estimation de cette probabilité est fondamentale, car toute démarche de production d'un nouveau vaccin en dépend. Le contexte est par définition incertain, et l'on ne saura qu'à la fin de l'épidémie si les décideurs ont eu raison.
La mutation des virus étant imprévisible, des mutants apparaissant partout et de façon désordonnée, il faut de manière permanente modifier le contenu de la réponse vaccinale.
Le contexte est compliqué, car vont circuler de manière simultanée plusieurs virus de la grippe : dans le cas présent, le H1N1 pandémique, le H1N1 classique et le H3N2 déjà connu, ce qui amènera les autorités sanitaires à recommander une double vaccination : l'une contre le virus pandémique, l'autre contre le virus saisonnier (principalement le H3N2).
Or le processus d'élaboration et de mise sur le marché d'un nouveau vaccin est long : identification de la souche par les centres de référence de plusieurs pays, consensus au niveau de l'OMS, diffusion aux industries, fabrication, tests, autorisations de mise sur le marché. Le processus s'étend sur plusieurs mois, sans que l'on ait de garanties sur sa durée qui peut néanmoins être écourtée si l'on décide de recourir à des mesures administratives d'urgence au moment d'autoriser la mise sur le marché.
Les décideurs savent donc, dès le départ, qu'il leur faudra gérer une situation caractérisée dans un premier temps par l'inexistence de vaccins, puis dans un deuxième temps par la montée en puissance de la production de vaccin, sans que l'on puisse éviter la pénurie si la pandémie se développe rapidement.
Cette situation de pénurie ne peut pas être évitée. C'est ce constat qui amènera tous les décideurs, dans tous les pays du monde, à définir quelles catégories de personnes devront être vaccinées de façon prioritaire, et à déterminer des degrés de priorité. Un climat de pénurie peut aussi conduire certains pays à accélérer des commandes fermes.
B - LES LIMITES CONNUES DES MÉDICAMENTS ANTIVIRAUX
Les médicaments antiviraux connus et utilisés sont peu nombreux.
Ceux qui contiennent de l'amantadine et de la rimantadine sont, on le sait, inefficaces en cas de grippe.
Ceux qui contiennent de l'oseltamivir ou du zanamivir sont par contre efficaces, sauf en cas de résistance.
Dans la pratique, seul l'un d'entre eux est utilisé : le Tamiflu. Le Relenza, théoriquement disponible, est en effet difficile d'usage, de par son mode d'administration. Le fabricant du Tamiflu, avant l'alerte du H5 N1, envisageait même d'en arrêter la fabrication.
Les nouveaux antiviraux qui résultent de recherches intenses ne sont pas encore utilisables.
Reste donc le Tamiflu, un médicament relativement récent, à l'égard duquel les médecins adoptent des attitudes différentes : certains le prescrivent, d'autres pas. Mais dans tous les cas, ce médicament n'est efficace que s'il est prescrit dans les 48 heures suivant l'apparition de l'infection.
Ses effets sont par ailleurs limités : il réduit généralement d'un jour la durée de la maladie. S'il en diminue généralement la gravité, il n'est pas capable d'en éviter les formes graves.
Le débat se poursuit sur ses conditions d'utilisation : Peut-il, doit-il être utilisé à titre préventif ? Doit-on le réserver à des formes graves de la grippe ? Si oui, comment définit-on ces formes graves ?
C - UNE SITUATION QUI PESERA SUR L'ORGANISATION DES SOINS
Dans un premier temps, les patients infectés sont orientés vers les hôpitaux où ils sont généralement confinés et isolés. Beaucoup craignent un débordement des capacités hospitalières, et plus particulièrement des services de réanimation.
Puis, dans un deuxième temps, et plus précisément à partir du 23 juillet 2009, ils sont orientés vers leurs médecins traitants et les pharmacies.
Les professionnels de santé libéraux, en particulier les médecins généralistes et les pharmaciens d'officines, sont, depuis cette date, chargés du dispositif de prise en charge des patients qui reconnaît le rôle de la médecine ambulatoire.
Une lettre de la Ministre de la Santé et des Sports aux médecins précise leur rôle.


Les pharmacies d'officine délivrent, sur prescription médicale, les masques chirurgicaux (gratuitement) et les antiviraux (remboursés par l'Assurance maladie). A cette époque, les stocks de Tamiflu en vrac constitués pour une pandémie H5 N1 ne sont pas libérés.
Pour les antiviraux, il convient de distinguer ceux destinés aux adultes et ceux à usage pédiatrique. Dans le premier cas, la pharmacie d'officine en fait la commande auprès du grossiste répartiteur en fonction du besoin. Les antiviraux pédiatriques sont disponibles auprès des seules pharmacies des grands hôpitaux.
D - LES CONSÉQUENCES SUR L'HÉMISPHÈRE SUD
Dans l'hémisphère Sud, atteint par le virus au moment de l'hiver austral, la prise en charge de la lutte contre ce nouveau virus est bien évidemment différente dans les pays développés et les pays en développement. Les premiers ont les moyens financiers, humains et logistiques pour soigner leur population, la majorité des autres non.
Dans les deux cas, les décideurs sont confrontés à une situation délicate : les souches vaccinales venant d'être identifiées, ils savent qu'ils ne pourront pas disposer de vaccin avant cinq à six mois. Il leur reste donc à mettre en place des mesures barrière et à utiliser le Tamiflu s'ils en disposent en quantité suffisante.
Dans le cas des pays en développement, le financement de ce médicament repose essentiellement sur l'aide internationale. Son utilisation relève de la souveraineté de chaque Etat. Il est du reste intéressant de noter de grandes différences d'attitude : le Chili a, par exemple, privilégié une large utilisation du Tamiflu, l'Argentine a, par contre, nié la réalité de la grippe dans un premier temps. Le nombre de cas graves et de décès dans les deux pays a été en conséquence très différent, ce qui a amené l'Argentine à changer de politique.
Dans tous les cas, le vaccin ne sera disponible en fait que s'il y a une deuxième vague pandémique (de fait, généralement l'année suivante à la même époque). Si, entre temps, le virus a muté, des études seront éventuellement menées pour fabriquer un vaccin adapté aux nouvelles conditions qui prévalent dans le Sud. L'Australie est le type même du pays capable de concevoir un tel produit, du fait de la capacité de son industrie pharmaceutique.
Dans de tels cas, il serait plus judicieux de pouvoir utiliser ces vaccins adaptés dans l'Outre-Mer français de l'hémisphère Sud, et de permettre à ces territoires de ne pas suivre les seules autorisations européennes de mise sur le marché.
DEUXIÈME PARTIE : LA RÉPONSE DES POUVOIRS PUBLICS
Cette réponse met en oeuvre plusieurs acteurs qui participent au processus décisionnel. Elle repose sur une évaluation de la situation et conduit à la mise en place d'une politique de prévention. En France, elle tient compte de la situation particulière de l'Outre-Mer.
I. LE PROCESSUS DÉCISIONNEL
Dans un contexte mondialisé, où les virus se déplacent à la vitesse des moyens de transport moderne, la prise en compte d'un nouveau virus présentant un risque pandémique est mondiale. Elle est le résultat de consultations entre l'OMS et ses Etats membres, sur la base de données fournies par des centres nationaux de référence.
Les décisions de l'OMS qui portent sur le degré de gravité de la situation fin avril puis mi-juin 2009 ont eu une influence considérable sur les décisions qui restent prises par les Etats qui, même au sein de l'Union européenne pour ceux qui en font partie, restent compétents pour ce qui concerne la santé publique.
L'action des pouvoirs publics va résulter des décisions prises à trois niveaux : au niveau mondial, au niveau européen pour les Etats membres de l'Union européenne et au niveau national.
A - LE RÔLE MAJEUR DE L'OMS DANS LA DÉFINITION D'UNE PANDÉMIE
L'OMS est au niveau mondial l'organisme qui a autorité pour attirer l'attention sur les situations les plus graves. Ses positions sont prises en référence à un cadre déjà existant définissant ce qu'est une crise.
Cette organisation internationale, qui regroupe 193 Etats, travaille étroitement avec leurs autorités sanitaires nationales, et dispose d'un réseau de centres de référence qui lui permet d'apprécier l'état d'une maladie, d'être documentée sur les souches en circulation et de distinguer si celles-ci peuvent se transformer en épidémie ou en pandémie.
L'état de pandémie est défini par l'OMS. Or la définition de ce terme n'est pas neutre.
Il faut tout d'abord préciser la différence entre épidémie et pandémie afin de prendre conscience des différents niveaux de propagation d'un virus.
Selon le Grand Robert , une épidémie se définit comme l'apparition d'un grand nombre de cas d'une maladie infectieuse transmissible, ou l'accroissement considérable du nombre de ces cas, dans une région donnée ou au sein d'une collectivité. C'est en cela qu'elle se distingue de l'endémie. Et le dictionnaire de citer les épidémies de choléra, de fièvre jaune, de typhus, de variole, de scarlatine, de croup, de rougeole et de grippe.
Le nombre important de cas est susceptible d'entraîner des mesures drastiques, telles que l'isolement, la quarantaine, afin de limiter le nombre de morts. Tant Michelet que Sainte Beuve et Camus font référence à ce phénomène étudié en particulier par Pasteur.
La pandémie, selon le même dictionnaire, est une maladie qui atteint presque tous les habitants d'une région, ou une épidémie générale dont les effets s'étendent à la terre entière.
Selon l'OMS, la pandémie se définit par sa dimension intercontinentale et peut être analysée selon six phases dans le cas de la grippe.
o Phase 1 : aucun cas d'infection chez l'homme due à un virus circulant chez les animaux n'a été signalé.
o Phase 2 : on sait qu'un virus grippal animal circulant chez des animaux domestiques ou sauvages a provoqué des infections chez l'homme et il est de ce fait considéré comme constituant une menace potentielle de pandémie.
o Phase 3 : un virus grippal réassorti animal ou animal-humain a été à l'origine de cas sporadiques ou de petits groupes de cas de maladie dans la population, mais n'a pas entraîné de transmission interhumaine suffisamment efficace pour maintenir les flambées à l'échelon communautaire.
o Phase 4 : la transmission interhumaine d'un virus grippal réassorti animal ou animal-humain capable de provoquer des flambées à l'échelon communautaire a été vérifiée.
o Phase 5 : le virus identifié a provoqué des flambées soutenues à l'échelon communautaire dans au moins deux pays d'une même région OMS.
o Phase 6 : outre les critères définis pour la phase 5, le même virus a provoqué des flambées soutenues à l'échelon communautaire dans au moins un pays d'une autre région de l'OMS.
Cette définition n'est pas gravée dans le marbre. L'OMS elle-même ne l'a adoptée qu'il y a quelques années.
La question principale va être de savoir quel niveau de pandémie est annoncé.
B - EN EUROPE, DEUX ORGANISMES JOUENT UN ROLE PARTICULIER
Il s'agit du Centre européen de prévention et de contrôle des maladies et de l'Agence européenne des médicaments qui interviennent dans un contexte où les Etats membres conservent des prérogatives importantes en matière de santé.
1. Le Centre européen de prévention et de contrôle des maladies
Le Centre européen de prévention et de contrôle des maladies (CEPCM/ECDC), créé en 1996 sous la forme d'une Agence de l'Union européenne dont le siège est à Stockholm, remplit une double tâche :
- identifier et évaluer les menaces émergentes pour la santé humaine des maladies transmissibles,
- établir, en coopération avec les États membres, des procédures afin de rechercher, recueillir, rassembler et analyser les informations et les données en vue de l'identification des menaces émergentes pour la santé qui pourraient avoir des conséquences sur la santé physique et mentale et qui pourraient affecter l'Union.
A cette fin, le CEPCM travaille en partenariat avec les organismes nationaux de protection de la santé à travers l'Europe pour renforcer et développer au niveau du continent des systèmes de surveillance des maladies et pour mettre en place des systèmes d'alerte précoce.
2. L'Agence européenne du Médicament
L'EMEA - European Medicines Evaluation Agency ou Agence Européenne du Médicament - , dont le siège est à Londres, est une agence communautaire créée en 1995 qui a pour objectif de protéger et de promouvoir la santé publique et animale à travers l'évaluation et la supervision des médicaments à usage humain et vétérinaire.
Elle est chargée de l'évaluation scientifique des demandes d'autorisation européennes de mise sur le marché des médicaments. Lorsqu'il est recouru à sa procédure centralisée, les sociétés ne soumettent à l'EMEA qu'une seule demande d'autorisation de mise sur le marché.
Elle suit par ailleurs la sécurité des médicaments grâce à son réseau de pharmacovigilance. Elle prend des mesures appropriées lorsque des rapports d'effets indésirables suggèrent des changements au niveau de l'équilibre bénéfice/risque d'un médicament. En ce qui concerne les médicaments vétérinaires, l'Agence est chargée de définir des limites sûres pour les résidus médicamenteux contenus dans les aliments d'origine animale.
L'Agence joue également un rôle dans la promotion de l'innovation et de la recherche dans l'industrie pharmaceutique. L'EMEA fournit aux sociétés des avis scientifiques et une assistance au niveau du protocole pour la mise au point de nouveaux médicaments. Elle publie également des directives sur les exigences en matière de tests de qualité, de sécurité et d'efficacité. Un bureau dédié créé en 2005 fournit une assistance spéciale aux petites et moyennes entreprises (PME).
L'Agence approuve les nouveaux médicaments et les nouveaux vaccins, mais c'est la Commission européenne qui est la seule habilitée à autoriser la mise en vente de ces produits lors de la procédure d'autorisation de mise sur le marché, l'AMM.
C - EN FRANCE, LA GESTION DE LA PANDÉMIE RELÈVE D'UN PILOTAGE INTERMINISTÉRIEL RELATIVEMENT COMPLEXE
1. Il faut coordonner l'activité de plusieurs acteurs publics et privés.
a) Cette coordination concerne plusieurs ministères
Plusieurs ministères sont concernés, à des degrés divers. Mais deux ministères vont jouer un rôle majeur dans le pilotage de la crise pandémique et dans la définition des mesures prises par les pouvoirs publics. Il s'agit du ministère de l'Intérieur, assisté du secrétariat d'Etat à l'Outre-Mer, et du ministère de la Santé et des sports.
Très rapidement, ces deux ministères vont travailler ensemble, se coordonnant au niveau interministériel avec des ministères sectoriels pour préparer et diffuser les circulaires qui définiront les mesures réglementaires qui devront s'appliquer pour prévenir et gérer la pandémie.
Citons, à titre d'exemple, la circulaire de 19 pages sur la planification logistique d'une campagne de vaccination contre le nouveau virus, en date du 21 août 2009.
Les deux ministres s'expriment fréquemment tant devant les media que les parlementaires qui les auditionnent de façon régulière.
Le ministre de l'Intérieur écrit aux élus, la ministre de la Santé aux médecins. Dans les deux cas, il s'agit d'atteindre les relais d'opinion et de créer un mouvement collectif de réaction à la crise pandémique.
Les deux ministères mettent conjointement en place un site Internet interministériel, présenté comme le site permettant de se préparer à un risque de pandémie grippale. Ils diffusent ainsi régulièrement à destination du grand public, des professionnels et des médias des informations mises à jour sur les menaces pandémiques. Ce site devient une référence, grâce à ses bulletins quotidiens, ses points de situation au niveau national et international, et ses recommandations.
Ces ministères peuvent demander l'avis de deux autorités consultatives : la Haute Autorité de Santé et le Haut Conseil de la Santé Publique
Des ministères techniques sont également concernés . Tous les services publics sont en fait concernés, quelle que soit l'autorité administrative dont ils relèvent.
Le ministère de l'Education nationale envisage les mesures à prendre en cas de diffusion du virus, et pose les principes applicables aux fermetures de classes. Son action est insuffisamment coordonnée avec celle du ministère de la Santé.
Le ministère des Affaires étrangères et européennes doit se soucier de la situation des Français de l'étranger, pays par pays, et de l'organisation de la vaccination dans ceux où elle n'est pas disponible. A titre d'exemple, les Français d'Egypte ont été personnellement invités à venir se faire vacciner à l'ambassade (où un vaccin monodose préparé était disponible) alors que les Français des Etats-Unis ont été invités à se rapprocher du système mis en place par ce pays.
Le ministère des Transports veille à la continuité des services publics, dans un contexte où les conducteurs de métro et de trains ne figurent pas parmi les catégories prioritaires.
Le ministère du Budget, des Comptes publics, de la Fonction publique et de la Réforme de l'Etat définit les dispositions à prendre pour la gestion des ressources humaines dans la fonction publique, afin de garantir la continuité de l'action de l'Etat (circulaire du 26 août 2009).
Globalement, la crainte d'une désorganisation massive du système économique et social a motivé la mobilisation des autorités publiques.
b) Cette coordination doit également concerner les activités des collectivités locales et tenir compte de l'organisation des professions médicales
- Les collectivités locales et leurs élus sont également en première ligne.
La lettre qu'adresse le ministre de l'Intérieur aux maires dès le 20 juillet 2009 est fort explicite.
En voici les principaux éléments :
« Afin de préparer l'arrivée d'une possible vague pandémique plus sévère dans les prochains mois, il convient de s'assurer que les plans de continuité d'activités des administrations de l'Etat, des collectivités territoriales, des entreprises et des opérateurs, mentionnés dans le plan national de prévention et de lutte « pandémie grippale (annexe, fiche G1) sont opérationnels.
L'objectif d'un plan de continuité est de maintenir l'activité au niveau le plus élevé possible, malgré un absentéisme important, tout en protégeant les personnes exposées. Il doit comprendre en particulier des mesures pratiques de fonctionnement en mode dégradé.
Dans l'exercice des responsabilités qui vous incombent, je vous serais reconnaissant de vous assurer qu'un tel travail est effectivement réalisé.
Les préfets se tiennent à votre disposition dans chaque département pour vous apporter aide et conseils. »
Ce plan de continuité envisage les mesures à prendre selon le nombre des personnes infectées qui seront obligées de rester à domicile. Il s'agit d'un texte de 11 pages, qui évalue l'enjeu, aborde les conséquences de la pandémie pour une administration et la manière de maintenir son activité au niveau le plus élevé possible tout en protégeant les personnels exposés.
Ce document repose sur l'analyse des missions et des conditions nécessaires à la continuité des fonctions de direction. S'appuyant sur une analyse des ressources humaines disponibles, il traite des méthodes et des moyens de protection et d'information des personnels ainsi que des modes d'organisation pour assurer le maintien de l'activité. Il fixe la liste des acquisitions préalables et prévoit dès maintenant les conditions de reprise des opérations à l'issue de la phase aiguë. Il étudie enfin la problématique du droit de retrait lors d'une pandémie grippale.
- Les professions médicales sont l'autre partenaire essentiel du gouvernement. Or les autorités ministérielles ont sous-estimé leur influence sur la population. Si le Conseil de l'Ordre a relayé les messages favorables à la vaccination, il n'en n'a pas été de même des médecins et des infirmières, qui n'ont pas été associés à la campagne de vaccination dans leurs cabinets et dont les remarques acerbes ont été relayées par leurs syndicats.
- Des entreprises ont par ailleurs élaboré en leur sein de remarquables plans de réponse à la grippe.
2. L'action de l'Etat repose sur la mise en oeuvre du plan national de prévention et de lutte « pandémie grippale »
a) Ce plan définit pour la France la pandémie
Selon le Plan national français de prévention et de lutte « Pandémie grippale » établi par le Secrétariat général de la Défense nationale le 20 février 2009, une pandémie grippale est caractérisée « par l'apparition d'un nouveau virus grippal contre lequel l'immunité de la population est faible ou nulle. Elle se traduit, sur l'ensemble du globe, par une forte augmentation dans l'espace et le temps des cas et de leur gravité. Un tel virus peut résulter d'échanges entre souches animales et humaines en évolution permanente ou de mutations progressives d'un virus animal. Dans certains cas, des virus ayant déjà circulé dans le passé peuvent réapparaître » .
La pandémie peut avoir des caractéristiques différentes : « Une pandémie, en l'absence de mesures efficaces, évolue habituellement en vagues successives pouvant durer chacune de 8 à 12 semaines, séparées de quelques mois voire davantage. La pandémie pourrait également survenir en une seule vague avec un taux d'attaque élevé (35%) sur une période de plus de 12 semaines ; elle pourrait aussi se dérouler sur plus de deux vagues » .
Elle peut donner lieu à des études scientifiques : selon ce même document, « la cinétique et l'impact d'une pandémie ont été modélisés par l'Institut de veille sanitaire sur la base des pandémies historiques. En l'absence d'intervention sanitaire, le bilan français pourrait s'établir de 9 à 21 millions de malades, et 91 000 à 212 000 décès en fin de pandémie. 500 000 à un million de personnes pourraient développer des complications nécessitant leur hospitalisation ».
b) Le plan français est plus détaillé que celui de l'OMS
Le document comparatif ci-après le montre clairement.
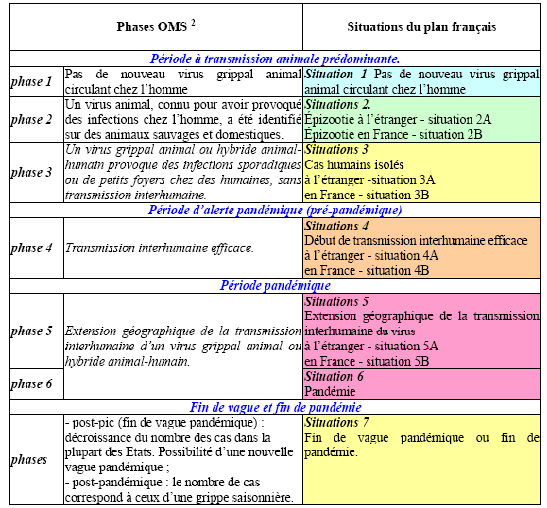
Source : Plan national de prévention et de lutte « Pandémie grippale », 20 février 2009, p.7
c) Son contenu est ambitieux
L'étendue des problèmes envisagés, comme celle des mesures à prendre en cas de forte pandémie, ne peuvent que frapper l'imagination. Toutes les activités sont concernées, de même que tous les secteurs d'activité. Il faut en fait prévoir comment assurer la continuité des services publics, de l'emploi, mais aussi de la vie sociale si la pandémie concernait 30 ou 40 % de la population. Au strict plan médical, il faut envisager la manière de mener un plan de vaccination à grande échelle, sans désorganiser le système de santé, et de traiter les cas graves sans porter atteinte au bon fonctionnement des services d'urgence et des unités de réanimation. De manière plus générale, il faut rendre la population consciente de la gravité potentielle de la situation sans pour autant l'effrayer.
C'est un plan global qui définit une stratégie générale et des principes de conduite opérationnelle de la crise après avoir déterminé une graduation de la réponse. C'est un document qui rentre dans le détail des mesures à prendre grâce à de fiches d'aide à la décision. Ses dispositions seront mises en oeuvre grâce à diverses circulaires émanant de plusieurs ministères.
Une analyse plus fine de ses dispositions sera faite dans le rapport final.
II - L'EVALUATION DE LA SITUATION : LE RÔLE DE LA VEILLE ET DE LA SURVEILLANCE SANITAIRES
Il s'agit d'observer l'évolution des épidémies dans les pays du monde entier, et plus particulièrement leur diffusion, leur incidence, leur létalité, selon les termes utilisés par le Professeur Hannoun.
La veille et la surveillance sanitaires sont organisées au niveaux mondial, européen et national par des structures qui échangent régulièrement leurs informations.
A - L'ALERTE AU NIVEAU MONDIAL : LE DOMAINE DE L'OMS
Lors de l'émergence de la grippe pandémique, l'OMS a réagi particulièrement rapidement.
Le 24 avril 2009, elle lance une alerte mondiale, signalant des centaines de cas de grippe aux Etats-Unis et au Mexique.
Le 11 juin, Mme Margaret Chan, directrice générale de l'Organisation Mondiale de la Santé, déclare la grippe A/H1N1 première pandémie du XXI° siècle et déclare atteint le niveau d'alerte 6.
Pour Mme Chan, qui s'exprime dans « Le Monde » du 30 et 31 août 2009, « Le H1N1 voyage à une vitesse inédite. Il est nouveau et quasiment personne n'est immunisé contre lui. Il se répand très facilement, mais ne provoque pas de maladie sévère chez la plupart des gens. Ces éléments ne cadrent pas avec les plans préparés, et imposent de les adapter. Rien d'étonnant, donc, à ce que des gens se demandent pourquoi la pandémie actuelle ne correspond pas à ce à quoi ils s'attendaient, et trouvent que l'on en fait beaucoup. Mais je ne suis pas d'accord avec ce point de vue » .
Par la suite, l'OMS a continué son travail de surveillance, mais son action s'est faite plus discrète. N'aurait-elle pas dû davantage communiquer sur l'état de la pandémie, et éventuellement diminuer le niveau de gravité qu'elle lui accordait ? Cette question mérite d'être posée à ses dirigeants, ce que vos rapporteurs feront lors d'une prochaine mission.
B - LA SITUATION EN EUROPE : LES INFORMATIONS DIFFUSÉES PAR LE CENTRE EUROPÉEN DE PREVENTION ET DE CONTRÔLE DES MALADIES
Le CEPCM publie régulièrement des cartes permettant de suivre l'évolution de la grippe et des décès. Voici, par exemple, celle qu'elle a publiée le 23 novembre 2009 sous le titre : « Forte hausse des décès liés à la grippe A(H1N1) en Europe ».
Cette date est intéressante car elle correspond au moment où les Français ont commencé à se sentir concernés par la vaccination, après l'avoir largement boudée.
Ladite carte donne une image du nombre cumulé de décès dus à la grippe pandémique dans les pays de l'Union européenne et de l'AELE au 23 novembre 2009.
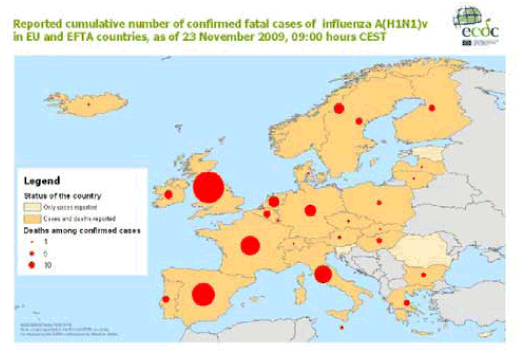
Le CEPCM, dont le siège est à Stockholm, constate que 169 décès liés au virus ont été recensés sur le continent au cours de la semaine écoulée. Le nombre de décès est en forte augmentation, doublant pratiquement toutes les deux semaines au cours des six dernières semaines. Cette hausse est particulièrement sensible en Europe centrale et orientale, alors que la plupart des décès se sont jusqu'à présent produits en Europe occidentale.
Cette information est cohérente avec les données diffusées par l'OMS qui à la même époque annonçait que la pandémie de grippe A(H1N1) se déplaçait vers l'est à travers l'Europe et l'Asie et semblait avoir atteint son pic dans plusieurs régions d'Europe occidentale ainsi qu'aux Etats-Unis.
L'analyse du CEPCM permet d'avoir une information plus précise sur l'Europe. C'est ainsi que lors de la semaine précédant cette publication, le CEPCM signalait des maladies grippales « de très haute intensité » en Italie, Norvège et Suède, de « haute » intensité en Allemagne, Bulgarie, Danemark, Islande, Irlande, Lituanie, Luxembourg, Pologne et Portugal, de « moyenne » intensité dans le reste de l'Europe.
C - LA SITUATION EN FRANCE
En France, la veille et la surveillance sanitaires dépendent de l'Institut national de veille sanitaire et de ses partenaires.
1. Le rôle majeur de l'Institut national de veille sanitaire
L'Institut national de veille sanitaire (InVS) « réunit les missions de surveillance, de vigilance et d'alerte dans tous les domaines de la santé publique. Créé par la loi du 1er juillet 1998 relative au renforcement de la veille sanitaire et au contrôle de la sécurité sanitaire des produits destinés à l'homme, l'InVS a vu ses missions complétées et renforcées par la loi du 9 août 2004 relative à la politique de santé publique, afin de répondre aux nouveaux défis révélés par les crises sanitaires récentes et les risques émergents ».
Ses missions recouvrent la surveillance et l'observation permanentes de l'état de santé de la population ; la veille et la vigilance sanitaire ; l'alerte sanitaire. Il contribue également à la gestion des situations de crise sanitaire en proposant aux pouvoirs publics toute mesure ou action nécessaire.
Il suit notamment les maladies infectieuses, l'infection par le VIH, les virus des hépatites B et C, ainsi que les maladies évitables par la vaccination.
Il est documenté par les réseaux Sentinelles (toutes maladies) et GROG (pour les grippes).
Il couvre également les risques internationaux et tropicaux : « maladies infectieuses touchant d'autres pays mais susceptibles d'atteindre des ressortissants français ou d'être importées (grippe aviaire, Ebola, fièvre jaune, arboviroses), maladies et menaces touchant les départements d'outre mer et les départements français d'Amérique : dengue, maladie de chagas, pollution par les pesticides ou le mercure ».
2. Les partenaires de l'InVS : les réseaux de surveillance spécifiques et non spécifiques
a) Le réseau Sentinelles
Le réseau Sentinelles regroupe 1300 médecins généralistes libéraux (2% de la totalité des médecins généralistes libéraux en France métropolitaine) bénévoles et volontaires répartis sur le territoire métropolitain français. Les médecins membres sont dits « médecins Sentinelles » .
Ce réseau, créé en novembre 1984 par le Professeur Alain-Jacques Valleron, est animé par l'Unité Mixte de Recherche en Santé UMR S 707 Inserm - Université Pierre et Marie Curie .
Il surveille de manière continue l'activité de consultation des médecins généralistes libéraux en France métropolitaine (en particulier en ce qui concerne la grippe), mène des recherches épidémiologiques et de terrain, et développe des outils d'information.
b) Les GROG
Créé en 1984, le réseau des GROG, réseau d'alerte précoce de la grippe, se présente comme un symbole de la participation des médecins libéraux à la Santé Publique.
Animé par le docteur Jean-Marie Cohen, il constitue un réseau d'alerte épidémiologique, qui se fixe pour objectifs :
- la détection précoce de la circulation des virus grippaux,
- la détermination du début de l'épidémie de grippe et de son évolution régionale et nationale,
- la surveillance des caractéristiques antigéniques des virus grippaux et de l'adéquation de la composition vaccinale,
- la surveillance de la circulation d'autres agents infectieux respiratoires (VRS, parainfluenzae...).
Il s'agit d'un réseau pluridisciplinaire qui confronte en temps réel des données virologiques (volume d'activité du réseau) et des données sanitaires (notamment nombre d'actes et d'infections respiratoires aiguës) collectées par des vigies.
c) SOS Médecins et le réseau Oscour
SOS Médecins permet d'évaluer les urgences médicales de ville, d'observer le poids de la grippe parmi les autres pathologies et d'avoir une idée des tendances au jour le jour.
Le réseau Oscour remonte, quant à lui, les diagnostics réalisés aux urgences de 220 hôpitaux sur l'ensemble du territoire.
D - LA RÉSULTANTE DE CES ACTIONS : ÉTAT DE L'INFORMATION DISPONIBLE
Il est important de se rappeler que la situation a beaucoup évolué et que les décisions ont été prises en fonction de l'information disponible. C'est pourquoi il est intéressant de comparer la situation à la mi-octobre, au moment où le virus se développait mais où il n'y avait aucun vaccin sur le marché, et celle à la fin janvier, où la situation est redevenue quasi-normale.
Ces deux dates correspondent, par ailleurs, à la validation par l'Office parlementaire de l'étude de faisabilité présentée par ses deux rapporteurs, et à l'élaboration de leur rapport d'étape.
1. A la mi-octobre 2009
Que pouvait-on trouver sur Internet alors que l'on assistait à une croissance de la pandémie, à la mi-octobre 2009, un peu moins de deux mois avant le pic pandémique ?
Voici quelles étaient les données disponibles sur l'état de la pandémie au plan mondial et français. Toutes étaient moins alarmistes qu'on ne l'avait pensé pendant l'été.
a) Les données fournies par l'OMS
Les informations disponibles sur le site de l'OMS à cette date remontent au 27 septembre 2009. L'OMS signale qu'il y a eu plus de 340 000 cas confirmés en laboratoire de la grippe pandémique H1N1 de 2009 et plus de 4100 décès qui lui ont été signalés.
Selon les informations diffusées, la transmission du virus de la grippe continue à augmenter dans les régions tempérées de l'hémisphère Nord et reste active dans les régions tropicales des Amériques et de l'Asie. Dans les régions tempérées de l'hémisphère austral (Chili, Argentine, Nouvelle-Zélande), la transmission de la grippe est largement retournée aux valeurs de départ. Elle a même diminué de manière substantielle en Australie et en Afrique du Sud.
28 virus résistants de cette grippe ont été détectés et caractérisés dans le monde. Tous ces virus présentent la même mutation H275Y qui confère la résistance à l'antiviral oseltamivir, mais pas au zanamivir antiviral. Aucun nouveau virus résistant n'a été officiellement notifié à l'OMS au cours de la semaine écoulée. Dans le monde, plus de 10 000 échantillons cliniques (échantillons et des isolats) du virus pandémique H1N1 ont été testés et jugés sensibles à l'oseltamivir.
NOMBRE D'INFECTIONS CONFIRMÉES ET DE DÉCÈS
|
Région |
Total cumulatif |
|
|
à compter du 27 Septembre 2009 |
||
|
Cas |
Décès |
|
|
Bureau régional OMS pour l'Afrique (AFRO) |
8352 |
42 |
|
Bureau régional OMS pour l' Amérique (AMRO) |
137147 |
3020 |
|
Bureau régional OMS pour la Méditerranée orientale (EMRO) |
12008 |
74 |
|
Bureau régional OMS pour l'Europe (EURO) |
Plus de 56000 |
Au moins 176 |
|
Bureau régional OMS pour l'Asie du Sud Est (SEARO) |
33594 |
413 |
|
Bureau régional OMS pour le Pacifique occidental (WPRO) |
96197 |
383 |
|
Total |
Plus de 343.298 |
Au moins 4108 |
b) Les données françaises
L'InVS publie chaque semaine des données sur la progression de la grippe en coordonnant les informations des Sentinelles et des GROG.
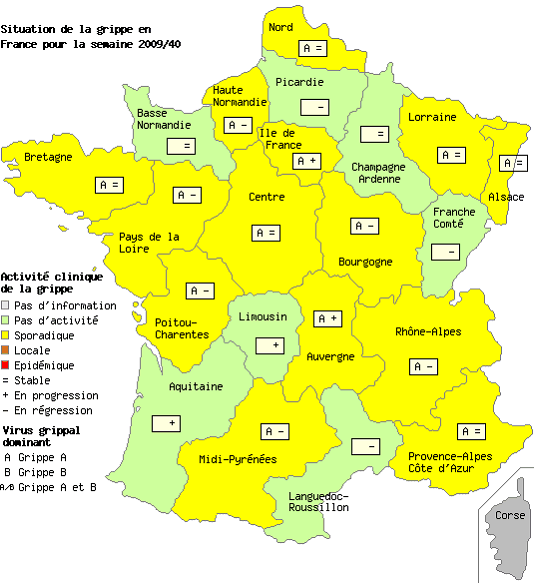
- Le réseau Sentinelles évaluait de la façon suivante la situation lors de la semaine du 28/09/2009 au 04/10/2009
« En France métropolitaine, la semaine dernière, l'incidence des syndromes grippaux vus en consultation de médecine générale a été estimée à 217 cas pour 100 000 habitants (soit 136 000 nouveaux cas), au-dessus du seuil pandémique (102 cas pour 100 000). Cette incidence, au-dessus du seuil mais d'intensité modérée, est stable depuis maintenant 4 semaines.
Au niveau régional, dix-sept régions avaient dépassé le seuil épidémique la semaine dernière. Les incidences les plus élevées ont été notées en : Champagne-Ardenne (539 cas pour 100 000 habitants), Nord-Pas-de-Calais (415), Poitou-Charentes (340), Rhône-Alpes (329), Basse-Normandie (232) et Provence-Alpes-Côte-d'Azur (226).
Concernant les cas rapportés, la semaine dernière, l'âge médian était de 24 ans (2 mois à 88 ans); les hommes représentaient 48% des cas. Les tableaux cliniques rapportés par les médecins Sentinelles ne présentaient pas de signe particulier de gravité (taux d'hospitalisation des cas rapportés inférieur à 1,1%). Quatre demandes d'hospitalisation dont 2 pour complications (respiratoires), et 2 pour mesures préventives (1 femme enceinte et 1 enfant dont la mère est enceinte et pour lequel il y a eu une demande de prélèvement).
L'excès de cas rapportés la semaine dernière, dans le contexte de la pandémie A(H1N1)2009, comparativement aux mêmes semaines des années passées, a été estimé à 116 000 cas environ. Ces chiffres doivent être interprétés en tenant compte du contexte de forte médiatisation, qui peut être à l'origine d'un excès de consultations chez des personnes qui n'auraient pas consulté en « temps normal ».

- L'information fournie par les GROG était complémentaire.
Les GROG ont diffusé les informations suivantes pour la semaine du 28 septembre au 4 octobre 2009 (semaine 40) sous le titre : « Le nombre de cas de grippe reste stable » .
« Selon les données du Réseau des GROG, la semaine dernière,
• sur les 1.115.000 cas d'infections
respiratoires aiguës (IRA), la grippe A(H1N1)2009 a
représenté seulement 39.800 cas soit environ 3% des consultations
médicales pour IRA,
• en médecine générale,
1 patient sur 8 a consulté pour IRA (soit 3 IRA/jour/médecin),
• en pédiatrie, 1 patient sur 6 a
consulté pour IRA (soit 4 IRA/jour/médecin).
Dans les prélèvements GROG, les virus respiratoires saisonniers responsables des IRA non grippales sont surtout le rhinovirus, incriminé dans environ 36% des cas et les entérovirus.
Le nombre des infections respiratoires aiguës s'est stabilisé. La part de la grippe dans ces IRA reste faible mais constante, confirmant que le virus A(H1N1)2009 est présent dans toutes les régions métropolitaines, prêt à provoquer une vague épidémique ».
c) Comment interpréter ces données ?
Ces statistiques ne sont bien sûr qu'un indicateur d'une réalité plus complexe. Toutes les personnes atteintes ne se manifestent pas. Parmi celles qui consultent dans notre pays, on estime à l'époque que seules 5% d'entre elles sont vraiment atteintes par la grippe, les autres souffrant de syndromes respiratoires (les virus de la grippe - qu'elle soit saisonnière ou pandémique - ne représentent qu'une infime partie des virus respiratoires existants). Il en serait autrement si la pandémie se développait. Enfin le diagnostic sans sérologie ne permet pas à 100% de qualifier la grippe d'un patient de pandémique ou saisonnière.
Au-delà des statistiques, il apparaît que le virus n'a pas muté de manière significative. Il est contagieux, mais moins qu'on ne le pensait si l'on s'en réfère à ce que l'on a constaté en Nouvelle Calédonie ou à La Réunion. Les données disponibles sur l'Australie, la Nouvelle Zélande et l'Amérique du Sud montrent néanmoins qu'il est plus contagieux que celui de la grippe saisonnière classique.
Le problème n'est pas tant dans la virulence du virus que dans l'extrême rapidité de son développement potentiel et dans le grand nombre d'infections qu'il pourrait provoquer. Cette année, le virus dominant dans le monde est celui de la grippe, dont la diffusion dépasse celle de la grippe saisonnière.
C'est pourquoi il est envisagé de mener des campagnes de vaccination de grande ampleur dans plusieurs pays, dont la France et les Etats-Unis.
Le Royaume-Uni a adopté jusqu'à présent une attitude différente, en distribuant largement le Tamiflu -un médicament anti-viral-, sans qu'il y ait forcément besoin de prescription médicale, ce qui est susceptible de poser à terme un certain nombre de problèmes. En Belgique, les médecins sont à la fois prescripteurs et distributeurs de médicaments.
Les vaccins vont être prochainement disponibles, tant aux Etats-Unis que dans l'Union européenne. Ils sont de même utilisés de façon importante en Chine, au Japon et en Australie.
Les autorités françaises considèrent, au vu de ces données, qu'elles n'ont pas à mettre en oeuvre la phase la plus contraignante du plan de lutte contre la pandémie, alors que l'OMS en est déjà arrivée à son niveau maximal, le 6. En restant mi-octobre au niveau 5A, elles gardent la possibilité de pouvoir s'adapter de manière progressive à l'évolution des évènements, et de graduer les mesures de prévention en fonction de la gravité des circonstances. Rappelons qu'en France, le niveau 6, au vu du plan consigné, aurait imposé l'arrêt d'une partie des transports publics et la fermeture de toutes les écoles.
2. Début février 2010
a) Les données de l'OMS
Dans sa mise à jour hebdomadaire en date du 29 janvier 2010, l'OMS fait état d'au moins 14 711 morts. Elle remarque que la transmission du virus reste active en Afrique du Nord et partiellement en Europe orientale et du Sud-Est, ainsi qu'en Asie orientale. Mais globalement, le virus est moins actif.
b) Les données françaises
Les Sentinelles ont publié les données suivantes dans leur bulletin hebdomadaire portant sur la semaine du 25 au 31 janvier 2010 :
« En France métropolitaine, la semaine dernière, l'incidence des syndromes grippaux vus en consultation de médecine générale a été estimée à 58 cas pour 100 000 habitants, en dessous du seuil épidémique (175 cas pour 100 000). Seule la Corse présente un niveau d'activité légèrement supérieur au seuil épidémique national avec 208 nouveaux cas pour 100 000 habitants. Concernant les cas rapportés, la semaine dernière, l'âge médian était de 30 ans (2 mois à 82 ans) ; les hommes représentaient 47% des cas. Les tableaux cliniques rapportés par les médecins Sentinelles ne présentaient pas de signe particulier de gravité : un cas d'hospitalisation pour complications respiratoires chez une patiente de 2 mois a été rapporté (soit 0,8% des cas).»

Source : Sentinelles
- Les GROG diffusaient pour leur part les informations suivantes sur leur site Internet pour la 4° semaine de 2010 sous le titre « Discrète, mais toujours là » .
« Selon les données du Réseau des GROG, pendant la semaine 2010/04 du lundi 25 au dimanche 31 janvier 2010 :
• Le virus pandémique reste présent
dans 7 % des prélèvements des médecins vigies du
Réseau des GROG.
• Au cours des deux dernières semaines
chez les médecins vigies du Réseau des GROG, les proportions de
consultations pour grippe A(H1N1)2009 étaient de :
- 5 % des IRA chez les patients âgés de 0 à 4 ans;
- 21% des IRA chez les patients âgés de 5 à 14 ans;
- 11 % des IRA chez les patients âgés de 15 à 64 ans;
- < 0,1% des IRA chez les patients âgés de 65 ans et plus.
• Sur les 975.000 consultations médicales
pour infections respiratoires aiguës (IRA), la grippe A(H1N1)2009 a
représenté 66 000 cas. Les autres cas d'IRA sont dus
à des agents infectieux respiratoires non grippaux, notamment le virus
respiratoire syncytial (VRS) : l'incidence des bronchiolites, en baisse depuis
2 semaines, a ré-augmenté la semaine dernière en
pédiatrie et en médecine générale, bien que les
niveaux actuels soient plus faibles que ceux des hivers
précédents.
L'estimation GROG du nombre hebdomadaire des cas de grippe en France métropolitaine est de 83 000 la semaine du 18 au 24 janvier 2010 et de 66 000 la semaine dernière (du 25 au 31 janvier 2010, donnée non consolidée). »




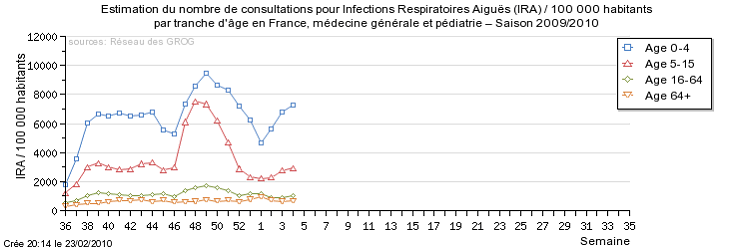
Source : GROG
c) Que conclure de cet ensemble d'informations ?
- Les données ainsi obtenues sont un outil d'analyse précieux.
Les cartes des Sentinelles et des GROG sont intéressantes. Les tableaux publiés par les GROG donnent une idée globale de l'évolution de la pandémie.
On note bien sa montée en puissance, puis son reflux. Le pic pandémique est visible. Les pouvoirs publics ont donc à leur disposition des instruments qui leur permettent d'étayer leurs décisions.
Globalement, le A(H1N1) est responsable en France d'environ 300 morts contre 2000 à 6000 par an pour la grippe saisonnière.
Les décisions présentées les premiers jours de janvier 2010 - renégociation du nombre de vaccins commandés, vaccination possible sans bon de vaccination - résultent de ces informations, d'autant plus que des études menées depuis quelques mois permettent d'apprécier de manière complémentaire l'ampleur et la gravité des phénomènes étudiés.
- D'autres indicateurs complémentaires pourraient être utilisés pour avoir une photographie plus complète de la situation.
Deux études récentes apportent en effet un éclairage nouveau sur la manière d'appréhender la réalité.
Selon la première, l'observation de l'activité de Google permettrait d'avoir une vision complémentaire et fiable de l'importance de la grippe. Il y a en effet un lien entre le nombre de connexions à ce site utilisant les mots clés liés à la grippe et le nombre de cas constatés.
Selon la seconde, le nombre de personnes touchées par la grippe a certainement été quatre à cinq fois supérieur à ce que l'on comptabilisait jusqu'à présent.
Cette étude, réalisée par des chercheurs de l'Unité des virus émergents de l'Université de Marseille sur un échantillon significatif de femmes enceintes à partir de recherches sérologiques, montre que cinq fois plus de femmes enceintes avaient été infectées par le virus pandémique que les données habituelles le laissaient penser. Le virus s'est donc répandu de manière importante, tout en prenant des formes différentes de ce qu'on prévoyait, ces formes étant le plus souvent bénignes.
Ces informations nouvelles doivent être prises en compte, car elles permettent de répondre à certaines critiques récurrentes sur l'appréhension du danger qui peut par ailleurs faire l'objet de scénarios et de simulations mathématiques.
III - LA MISE EN PLACE D'UNE POLITIQUE DE PRÉVENTION
Quelle que soit la gravité de la situation, il faut tout à la fois que les nouveaux vaccins soient préparés, qu'ils soient soumis aux essais cliniques nécessaires et qu'ils obtiennent l'autorisation de mise sur le marché.
Il faut simultanément passer commande aux laboratoires pharmaceutiques pour que les vaccins soient disponibles en temps utile et en quantité suffisante.
Il faut enfin organiser la vaccination qui débutera lors de la livraison des premiers vaccins autorisés.
A - LES ÉTAPES NÉCESSAIRES À LA PRÉPARATION D'UN NOUVEAU VACCIN
1. L'identification des souches vaccinales
C'est le rôle de l'OMS et des centres avec lesquels elle travaille.
Ses 200 centres de référence nationaux, répartis dans le monde entier, récupèrent des échantillons biologiques de patients grippés et transmettent un certain nombre de virus qu'ils ont isolés à un deuxième niveau de laboratoires, les centres mondiaux de référence (l'Institut Pasteur devrait prochainement devenir centre mondial de référence). Ceux-ci identifient les souches qui vont être sélectionnées.
A la fin de ce processus, l'OMS choisit le virus permettant de faire le vaccin et le met à la disposition des entreprises pharmaceutiques.
2. L'élaboration des nouveaux vaccins par les laboratoires pharmaceutiques
Ainsi que l'explique l'Agence européenne du Médicament, les vaccins contre la grippe saisonnière ne sont pas destinés à être utilisés au cours d'une pandémie. Il faut donc élaborer des vaccins spéciaux contre la grippe pandémique afin de renforcer la protection contre le virus pandémique chez les personnes qui n'ont pas encore été exposées à ce virus.
Jusqu'au début de la pandémie, toutefois, la souche du virus de la grippe qui sera impliquée n'est pas connue. Par conséquent, les vaccins contre la grippe pandémique ne peuvent être préparés qu'une fois que la pandémie a commencé et que la souche du virus de la grippe responsable a été identifiée.
La préparation de vaccins nouveaux a toutefois été largement anticipée, par l'élaboration de vaccins prototypes et de vaccins prépandémiques.
Les vaccins prototypes contiennent une souche du virus de la grippe qui a été spécifiquement choisie parce que très proche du futur virus pandémique auquel la population n'a pas encore été exposée. Lorsque l'OMS a identifié la souche apte à combattre la pandémie, celle-ci va remplacer la souche d'origine dans le vaccin maquette (mock-up) . Cela permet de réduire le temps nécessaire pour préparer un nouveau vaccin et empêcher la propagation de la pandémie.
Les vaccins prépandémiques sont quant à eux destinés à être utilisés avant une pandémie pour se protéger contre une souche de grippe qui devrait provoquer une pandémie à venir. Les vaccins prépandémiques disponibles en avril 2009 contenaient le virus de l'influenza de type A/H5N1 ( "grippe aviaire") parce que les experts de santé s'attendaient à ce que cette souche provoque la prochaine pandémie de grippe.
3. Les essais cliniques
a) Des procédures d'autorisation bien connues
Dans l'Union européenne, la recommandation EMEA/CPMP/SWP/465/95 de juin 1998 est le texte de référence pour les vaccins.
En France, l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS) joue un rôle particulier.
Cette Agence, créée par la loi du 1er juillet 1998, instituant un dispositif de veille et de sécurité sanitaires, est un établissement public de l'Etat placé sous tutelle du ministère chargé de la santé. Sa mission est de garantir la sécurité d'emploi, la qualité et le bon usage des produits de santé. Sa compétence s'applique notamment aux médicaments.
Elle fixe les délais de décisions et définit les processus d'autorisation, ainsi que le temps nécessaire pour les tests et les vérifications.
Les délais de décision, de manière générale, s'étendent de 30 à 90 jours. Dans le cas d'autorisation implicite, l'absence de réponse vaut autorisation, et le délai maximal est de 60 jours. Dans le cas d'autorisation explicite (écrite), l'absence de réponse correspond à un refus d'autorisation, et le délai varie entre 60 et 90 jours.
Ces délais peuvent être raccourcis.
En 2007, sur 1000 demandes d'autorisations cliniques de médicaments (en dehors des essais de thérapie cellulaire et génique), seuls 10 dossiers ont concerné les vaccins. Par contre, la sécurité virale a été vérifiée dans 217 cas.
b) Les essais cliniques des vaccins contre le A(H1N1)
Ces essais ont concerné les vaccins sans adjuvant, dès la mi-octobre, afin de déterminer si le vaccin sans adjuvant est suffisamment protecteur, après une ou deux injections.
Deux études ont ainsi été menées sur 120 femmes enceintes à partir du deuxième trimestre de la grossesse (au Centre d'investigation clinique de vaccinologie Cochin-Pasteur) et sur 120 personnes ayant eu une transplantation rénale (l'absence d'adjuvant étant recommandée dans ce cas comme dans celui des maladies auto-immunes, afin d'éviter les risques de déstabilisation liés à une surstimulation du système immunitaire).
Ces essais ont aussi concerné 240 patients séropositifs pour savoir comment ils réagissaient aux vaccins avec adjuvant.
4. L'autorisation de mise sur le marché
Dès juillet 2009, l'EMEA indique qu'elle a commencé à recevoir des données sur des vaccins contre la grippe A(H1N1) et s'engage à « en hâter l'examen » au fur et à mesure qu'elle les recevra.
« Etant donné la menace à la santé publique posée par l'actuelle pandémie, le but de l'EMEA est de s'assurer que les données soumises pour l'obtention d'autorisations soient examinées aussi vite que possible, avant le début de la saison grippale prévue en septembre. Le Comité pour les médicaments à usage humain de l'EMEA est déjà en train de passer en revue les données relatives à la fabrication, les fabricants entament des essais cliniques sur adultes et enfants et les résultats seront examinés dans les mois à venir au fur et à mesure qu'ils sont disponibles.
Quatre coquilles de vaccins développées par les laboratoires Baxter, GlaxoSmithKline et Novartis ont déjà été approuvées par l'Union européenne, sur la base de données générées avec la souche du virus H5N1 qui est similaire au H1N1, rappelle l'agence. Ces vaccins ont été développés en sachant que la souche de virus pourrait être changée en cas de pandémie déclarée, pour y inclure la souche causant la pandémie ». A eux quatre, ils ont été testés sur plus de 8000 personnes. Un recul de plusieurs décennies sur les vaccins contre la grippe saisonnière montre que l'insertion d'une nouvelle souche dans un vaccin (ce qui sera le cas lors du remplacement du H5N1 par le H1N1 dans les coquilles de vaccin) n'affecte pas de manière tangible la sécurité ou le niveau de protection ».
« Le comité étudie aussi de manière accélérée les données relatives à de nouveaux vaccins contre des pandémies de grippe, que lui fournissent actuellement GlaxoSmithKline et Sanofi Pasteur. Pour chaque vaccin, le Comité fera une recommandation à la Commission européenne en vue de son autorisation finale, après quoi l'utilisation des vaccins dans chaque Etat membre dépendra des recommandations nationales et de la disponibilité des vaccins dans chaque pays. »
Le 25 septembre 2009, l'EMEA a approuvé les vaccins des laboratoires GlaxoSmithKline et Novartis baptisés Pandemrix et Focetria. Le 2 octobre, elle a donné son feu vert à un vaccin contre la grippe A (H1N1) fabriqué par le laboratoire Baxter, le Celvapan.
B. LES COMMANDES PUBLIQUES
Ces commandes relèvent de la responsabilité de l'établissement de Préparation et de Réponse aux Urgences Sanitaires (EPRUS).
Créé par la loi du 5 mars 2007, cet établissement public administratif est chargé de mettre en place un corps de réserve sanitaire et de gérer les stocks et la logistique d'approvisionnement des produits pharmaceutiques nécessaires en vue de répondre aux situations de catastrophe, d'urgence ou de menace sanitaires graves sur le territoire national ou à l'étranger.
Son intervention s'inscrit dans un contexte économique où il faut commander plusieurs produits de prévention et de soin, alors que n'existe qu'un nombre limité de producteurs.
Ces commandes portent sur plusieurs produits : des masques, des tests, des médicaments antiviraux et des vaccins
1. Les commandes de masques
Il existe divers types de masques pour se protéger de la grippe :
Les premiers, en papier, sont trop rudimentaires pour être efficaces.
Les seconds, dits chirurgicaux, en 3 plis non tissés, sont habituellement utilisés par les professionnels de santé, mais ne sont pas toujours suffisants dans le cas actuel. Ils servent essentiellement à protéger l'entourage des personnes infectées. Ils protégent également les personnes qui les portent contre les projections de gouttelettes émises par une autre personne en vis-à-vis. Par contre, ils ne protègent pas contre l'inhalation de particules en suspension dans l'air.
Le troisième type, conseillé par le ministère de la santé pour lutter contre la propagation du virus A(H1N1), a un pouvoir filtrant supérieur et correspond à la norme CE EN 149 / FFP2. Il est présenté comme un appareil de protection respiratoire, réservé aux professionnels de santé. Mais est aussi conseillé aux personnes qui côtoient le public de façon rapprochée comme les caissiers, les vendeurs, les employés des banques.
Il existe enfin un quatrième type, encore plus protecteur : le masque-cagoule doté d'un filtre FFP2, qui protège tous les orifices de la tête (et pas seulement la bouche et le nez comme les autres masques), mais aussi les yeux, les oreilles, ainsi que le visage, les cheveux.. Il est recommandé pour les personnes intervenant en zone à risque de grippe aviaire / porcine / A H1N1.
D'après un article du Figaro du 29 juillet 2009, la vente de masques de protection explose. Les Français les porteront cependant peu.
Il existe en France six producteurs de masques, dont Macopharma, Sperian Protection et Altex. Aux Etats-Unis, 3M en est l'un des principaux fabricants. Les fabricants chinois représentent quant à eux 60 % des annonces sur Internet relatives aux masques FFP2.
La France a constitué un stock d'un milliard de masques chirurgicaux qui pourront être acquis dans les pharmacies sur prescription médicale. Mais il ne s'agit que de masques classiques qui empêchent la personne qui en porte de propager le virus via des gouttelettes de salive, et non du masque FFP2, à forte capacité de filtration qui protège des personnes contaminées. Ce chiffre est impressionnant, mais il faut savoir qu'un masque doit être changé toutes les quatre heures pour être efficace.
2. Les commandes de tests
Lorsque la souche d'un virus est identifiée, des laboratoires peuvent élaborer un test qui permet de savoir si un individu a été infecté par le virus concerné.
En France, un rôle majeur revient à l'Institut Pasteur qui a élaboré un test permettant de définir l'exposition à la grippe A(H1N1).
D'autres tests sont également disponibles sur le marché, mais leur qualité est fort variable. Promettant des résultats en un temps très court, ils sont évidemment beaucoup moins fiables, et il est difficile de définir dans quelle mesure ils sont surs.
Les tests sérieux ne sont généralement pas effectués en grande quantité, car la capacité des laboratoires hospitaliers à les analyser est limitée. C'est ainsi que le 7 octobre, le professeur Bricaire estimait qu'à Paris cette capacité ne dépassait pas le traitement d'une quinzaine de tests par jour tant à La Salpétrière, qu'à Bichat, ou à Bégin.
Les laboratoires d'analyse privés ne sont pas généralement équipés à cette fin.
Le nombre de tests à commander est d'autant plus limité que le temps nécessaire pour obtenir des résultats est généralement de l'ordre de 12 heures (Or le Tamiflu n'est efficace que pendant 48 heures après le début de l'infection). Les virologues déclarent par ailleurs que lorsque la pandémie se développe, il n'y a plus vraiment besoin de les utiliser.
Les tests de l'Institut Pasteur vont donc être réservés aux personnes présentant des cas graves.
3. Les commandes de médicaments antiviraux
Il existe peu de médicaments antiviraux efficaces contre la grippe pandémique, une fois qu'elle est déclarée. Le Relenza, produit par GSK, est d'utilisation difficile. Le Tamiflu, produit par Roche, est en fait le seul adapté.
Ces médicaments présentent les caractéristiques suivantes :
Le Relenza, qui contient la molécule du zanamivir est un antiviral inhibiteur de la neuraminidase.
Produit par le laboratoire GSK-GlaxoSmithKline, il est utilisé en inhalation pour traiter la grippe. Il inhibe en effet la multiplication du virus de la grippe au niveau des voies respiratoires.
Le Tamiflu, qui a la même fonction, est composé d'oseltamivir, et est un antiviral inhibiteur sélectif de la neuraminidase. Il peut être administré à l'enfant de plus d'un an. Les Etats-Unis ont utilisé une loi permettant les procédures d'urgence pour l'autoriser en dessous de un an sans recourir à tous les essais habituellement obligatoires.
Le Tamiflu est généralement produit à partir de la badiane étoilée, produit cultivé principalement en Chine.
L'EPRUS a constitué un stock de 33 millions de doses de Tamiflu, stock supérieur à la prévision maximale du nombre de malades (20 millions estimés lors de la constitution du stock).
4. Les commandes de vaccins
a) Les commandes porteront en France sur 94 millions de doses
Ce chiffre a été calculé en estimant que 70 % de la population voudrait se faire vacciner, qu'il serait nécessaire de procéder à deux injections de vaccins, et que 10 % du stock ainsi constitué serait donné aux pays du Tiers Monde.
Les commandes ont été passées auprès de quatre laboratoires :
- Novartis, producteur du Focetria et du Celtura, deux vaccins avec adjuvant, le premier à partir de cultures classiques, le second à partir de cultures cellulaires et qui les destine principalement à la France et aux Pays Bas;
- GlaxoSmithKline qui fabrique le Pamdemrix, vaccin avec l'adjuvant ASO3, et qui contient 3,75 microgrammes d'antigène du virus, notamment pour la France, l'Allemagne, la Grande Bretagne, la Belgique et la Finlande ;
- Sanofi Pasteur qui fabrique l'Humenza avec l'adjuvant AF03, dosé à 3,8 microgrammes, et le Panenza, sans adjuvant, dosé à 15 microgrammes d'hémagglutinine notamment pour la France;
- Baxter qui produit le vaccin sans adjuvant Celvapan, notamment pour la France, l'Allemagne, la Grande Bretagne et l'Irlande.
Ces entreprises ont une stratégie mondiale et sont aussi présentes aux Etats-Unis. Certains de leurs vaccins seront distribués hors de l'Union européenne, et en particulier en Suisse, au Japon, au Canada, au Mexique, en Nouvelle Zélande et au Brésil.
Ces commandes ne sont que la première étape du processus déjà décrit qui va comprendre des essais cliniques afin d'aboutir à une autorisation de mise sur la marché (AMM), décision dépendant de la Commission européenne sur recommandation de l'Agence européenne du médicament.
Il faudra attendre le mardi 27 octobre 2009 pour que cette autorisation soit donnée à deux premiers vaccins contre la grippe A, l'un du laboratoire suisse Novartis et l'autre du laboratoire britannique GlaxoSmithKline. Les vaccins seront autorisés dans tous les pays de l'Union européenne ainsi qu'en Islande, au Liechtenstein et en Norvège.
b) Les comparaisons internationales disponibles montrent que plusieurs pays ont adopté la même politique de précaution que la France
Beaucoup de pays comparables à la France adoptent la même politique. Seuls les Suédois et les Canadiens accepteront de se faire vacciner en masse.
COMMANDES DE VACCINS ET RÉSULTAT DE LA VACCINATION
|
Pays |
Doses commandées (en millions) |
% de la population pouvant ainsi être couverte |
% de la population vaccinée |
|
Grande Bretagne |
132 |
107 |
5 |
|
Suède |
18 |
97,8 |
60 |
|
France |
94 |
75,5 |
8,3 |
|
Canada |
50,5 |
75,4 |
60 |
|
Belgique |
12,6 |
60 |
15 |
|
Espagne |
37 |
41,2 |
4,5 |
|
Italie |
48 |
40,7 |
16 |
|
Etats Unis |
251 |
42 |
20,3 |
|
Allemagne |
50 |
30 |
5 |
Source des données : Espace Social Européen, du 22 au 28 janvier 2010
5. Au niveau mondial, ces commandes diverses portent sur des chiffres impressionnants.
En France, les dépenses envisagées sont d'un milliard et demi d'euros. Seront ainsi achetées 94 millions de doses de vaccin auprès de GSK, de SanofiPasteur et de Novartis, 9 millions de doses de Relenza à GSK et 24 millions de boîtes de Tamiflu à Roche.
A l'étranger, les financements en cause sont tout aussi conséquents. En Espagne, par exemple, le gouvernement a prévu 333 millions d'euros pour la lutte contre la pandémie.
Au niveau mondial, plus d'un milliard de doses de vaccin ont été commandées dans l'hémisphère Nord depuis l'apparition du virus A/H1N1, pour un montant de quelque 10 milliards d'euros. Le secteur de la production de vaccins devrait ainsi générer 20 milliards de dollars de chiffre d'affaires à l'horizon 2012.
Depuis avril, 200 millions de doses de Tamiflu ont été commandés par 85 pays. Les ventes en ont été multipliées par 12 au deuxième trimestre 2009 par rapport au deuxième trimestre 2008. Le chiffre d'affaires généré par ces ventes devrait s'élever à plus de 1,3 milliard d'euros en 2009. Une partie des profits sera reversée à l'américain Gilead, découvreur de la molécule.
Novartis, qui a débuté avec les études cliniques en juillet, prévoit de fournir 100 millions de doses de vaccin d'ici la fin 2009. Le gouvernement français en a commandé 16 millions de doses et 8 millions en option.
Les ventes de Relenza sont relancées, alors que ce médicament allait être abandonné du fait de ses contraintes, puisqu'il doit être inhalé.
C - LA MISE EN PLACE DE LA VACCINATION
1. Une circulaire la met en place
Cette circulaire conjointe du ministère de l'intérieur, de l'Outre-Mer et des collectivités territoriales, et du ministère de la Santé et des sports du 21 août 2009 met en place une « planification logistique d'une campagne de vaccination contre le nouveau virus A(H1N1) ». Adressée aux préfets, elle a pour but de préparer « une grande campagne de vaccination », sur quatre mois. Cette campagne n'a pas vocation à se renouveler l'an prochain.
Rappelant les contraintes liées à la nécessité d'une traçabilité individuelle, au caractère progressif des livraisons et aux volumes de données à traiter, elle dispose que chaque préfet établira un plan départemental de vaccination, et déterminera un minimum de trois sites de vaccination spécialement créés pour l'occasion, notamment dans des gymnases ou des salles polyvalentes, en étroite relation avec les collectivités territoriales.
Elle prévoit la vaccination des élèves par des équipes mobiles dans les établissements scolaires. Elle fixe la composition des équipes de vaccination. L'équipe type comprend des personnels administratifs ou techniques, des personnels soignants travaillant sous la responsabilité d'un professionnel de santé de plein exercice, des paramédicaux de plein exercice, et des médecins ou internes en médecine, soit au total de 15 personnes. Cette équipe type prendra en charge sur une durée de quatre heures, 360 personnes, à raison de 3 agents vaccinateurs par équipe et de 30 injections par heure et par agent vaccinateur.
Elle précise que le poste de vaccination est composé de trois agents :
- un agent chargé de la préparation de la vaccination, assurant la reconstitution du vaccin et le remplissage des seringues équipées d'aiguilles serties (personnel soignant) ;
- d'un agent vaccinateur (personnel soignant) ;
- d'un agent chargé de la traçabilité (personnel administratif).
Elle détermine les profils des personnels composant les équipes de vaccination. Elle prévoit la recherche en priorité de volontaires, mais aussi une réquisition « qui apportera, le moment venu, le formalisme nécessaire à la couverture et à la rémunération et, le cas échéant, sera l'instrument d'une mobilisation complémentaire ».
2. Des choix annoncés et assumés
Les ministres concernés présentent régulièrement leur politique et défendent les choix qui ont été faits.
a) Dans un contexte de pénurie, seront d'abord vaccinées les personnes considérées comme prioritaires
Ce choix se retrouve dans les autres pays.
Le 24 septembre 2009, le Premier Ministre et la ministre de la Santé ont annoncé dans quel ordre de priorité il serait possible de se faire vacciner lorsque les autorisations de mise sur le marché auront été délivrées. La liste ci-dessous reprend les recommandations du Haut Conseil de Santé Publique.
|
PERSONNES INVITÉES À SE FAIRE VACCINER PAR ORDRE DE PRIORITÉ - Personnels de santé de réanimation néonatale et pédiatrique - Personnels médical, paramédical et aide-soignant des établissements de santé ainsi que médecins et infirmiers du secteur ambulatoire exposés à des patients grippés ou en contact avec des patients porteurs de facteurs de risque |
|
- Femmes enceintes (à partir du 2 è trimestre) |
|
- - Entourage des nourrissons de moins de 6 mois (famille et personnes assurant la garde de ces nourrissons) |
|
- Professionnels chargés de l'accueil de la petite enfance (jusqu'à 3 ans) |
|
- Nourrissons âgés de 6 à 23 mois révolus avec des facteurs de risque (atteints de pathologies chroniques sévères) |
|
- Sujets âgés de 2 à 64 ans avec facteurs de risque |
|
- Autres professionnels de santé, professionnels de secours et transporteurs sanitaires |
|
- Nourrissons de 6 à 23 mois révolus sans facteur de risque |
|
- Personnels d'accueil des pharmacies |
|
- Personnels des établissements médico-sociaux |
|
- Plus de 65 ans avec facteurs de risque |
|
- 2 à 18 ans sans facteur de risque |
|
- Plus de 18 ans sans facteur de risque |
Cette liste paraît rationnelle lorsqu'elle est annoncée. On s'apercevra par la suite qu'elle n'était pas suffisamment détaillée et qu'elle n'incluait pas des catégories de population particulièrement sensibles aux infections respiratoires aigues.
Jusque début janvier, il fallait donc prouver que l'on appartenait à l'une de ces catégories pour être vacciné, en montrant le bon de vaccination que tout citoyen devait recevoir de sa caisse de sécurité sociale. Très souvent, ces bons sont parvenus chez les Français au moment où la ministre de la Santé annonçait qu'ils n'étaient plus nécessaires.
Courant décembre, certaines personnes pouvaient néanmoins être vaccinées sans bon, selon l'appréciation du responsable du centre de vaccination, variable selon les lieux, mais leur nombre fut très faible.
b) La vaccination ne sera pas obligatoire
C'est une annonce du Premier Ministre qui précise qu'elle sera proposée à tout Français souhaitant se faire vacciner. La campagne de vaccination se fera au fur et à mesure de l'arrivée des vaccins. Le gouvernement a décidé qu'il n'y aurait aucune avance de frais, le tiers payant étant intégral.
c) La vaccination ne sera faite que dans des centres dédiés
Il en résulte que les praticiens libéraux ne pourront pas vacciner dans leurs cabinets. Les autorités sanitaires expliquent ce choix en invoquant les phénomènes de contagion dans les salles d'attente et les difficultés matérielles de la vaccination à partir du moment où les vaccins sont conditionnés en dix doses. Elles ajoutent par ailleurs que la vaccination en centre dédié permettra de vacciner plus rapidement davantage de personnes.
Cette décision, propre à notre pays, va être source de grandes rancoeurs chez les professions médicales, et entraînera des réactions défavorables de leur part. Les arguments entendus pour justifier ce choix (problème de chaîne du froid, garantie de traçabilité) ont accru leur désapprobation.
Elle entraînera de fortes réticences à la vaccination chez le personnel médical, qui auront un impact certain sur la population, tout aussi réticente, pendant de nombreuses semaines, jusqu'à l'annonce de la mutation du virus en Norvège. Cette « période de grâce » sera cependant courte et fin janvier, il n'y avait que moins de six millions de Français vaccinés. Ce chiffre confirme une tendance lourde puisque, fin octobre, seuls 17 % des Français étaient disposés à se faire vacciner, selon un sondage IFOP du 24-25 octobre 2009.
L'analyse des sondages et des déclarations des syndicats est particulièrement révélatrice.
Pour M. Thierry Amouroux, Secrétaire Général du Syndicat National des Professionnels infirmiers, « injecter 94 millions de doses d'un produit sur lequel nous n'avons aucun recul peut poser un problème de santé publique, et il est de notre devoir d'infirmières d'informer correctement la population, pour que chacun prenne sa décision en toute connaissance de cause, par un consentement libre et éclairé, et non par une campagne de publicité et des discours alarmistes » .
Le syndicat des infirmières, pour sa part, a fait part de son scepticisme et relève qu'une vaccination massive contre un virus grippal relativement bénin, présente des risques, du fait d'un vaccin développé trop rapidement, et d'un adjuvant susceptible de déclencher des maladies auto-immunes.
IV - L'APPLICATION DE CETTE POLITIQUE DANS L'OUTRE-MER FRANÇAIS
Il était nécessaire de tenir compte de ses spécificités.
De manière générale, la problématique, comme les procédures ont donc été identiques à ce qui fut mis en place en métropole avec quelques mois de décalage. Les spécificités constatées sont largement dues au décalage des saisons et à l'absence totale de vaccins lorsque la pandémie a démarré.
Deux exemples seront abordés : l'un, plus longuement est celui de La Réunion ; le second, plus rapidement, celui de la Guyane.
A - LA SITUATION À LA RÉUNION
Etudier la grippe à La Réunion est particulièrement intéressant car ce département d'Outre Mer de l'Océan indien a été profondément marqué récemment par l'impact d'un autre virus, le chikungunia.
Ce mot, qui veut dire «homme courbé » décrit bien les conséquences possibles de ce virus qui laisse encore aujourd'hui des séquelles dans une partie importante de la population réunionnaise.
La gestion de la crise du chikungunia avait mis en tension la presse avide de renseignements, mais aussi de titres sensationnels, la CIRE, cellule de veille, harcelée, les praticiens, débordés par le nombre de cas, et le Préfet de l'époque verrouillant la diffusion de l'information pour qu'il ne soit parlé que d'une voix. Cette crise sera plus particulièrement relatée dans le rapport final.
L'apparition du A(H1N1) à La Réunion a donc réveillé des souvenirs encore vivaces.
Dans le contexte type de l'hémisphère sud - aucun vaccin n'était disponible lors de la diffusion massive du virus en juillet-août 2009 - il est par ailleurs particulièrement intéressant d'examiner comment se sont mises en place les mesures de protection contre la pandémie, comment celle-ci a été surveillée, et comment les scientifiques locaux se sont mobilisés.
1. La gestion de la crise a relevé du Préfet
C'est le Préfet qui a souhaité dès le départ que la communication sur la pandémie soit unique et relève de son autorité, afin d'assurer une plus grande efficacité.
C'est également le Préfet qui est intervenu pour apprécier s'il convenait ou non de fermer les écoles, comme en métropole, à un moment où le pic pandémique était passé. C'est lui qui a décidé de s'opposer à la fermeture d'une école qui avait été envisagée par le diocèse, mais qui n'était pas suffisamment motivée. Aucune école n'a donc fermé à La Réunion. Le Préfet a ainsi utilisé la liberté de manoeuvre dont il disposait pour tenir compte des circonstances locales.
Le Préfet a particulièrement suivi les difficultés nées d'une situation locale spécifique : le Conseil général s'était opposé au personnel chargé de l'assistance et de l'accompagnement des personnes isolées. Le conflit qui en a résulté a conduit à une situation où certains soins essentiels n'étaient plus assurés. Cette crise a eu des conséquences d'autant plus graves pour les personnes isolées que les médecins libéraux de l'île ne font pas de visite à domicile.
Le Préfet a été amené à suivre les difficultés d'application de deux circulaires ministérielles : la première concernait le dépistage systématique des femmes enceintes qui devaient venir à l'hôpital pour des prélèvements et pour vérifier si elles avaient besoin de Tamiflu ; la seconde prévoyait que la vaccination devait être proposée à tous les malades en hôpital, disposition qui n'a pas été appliquée du fait des contre-indications possibles.
2. La veille et la surveillance sanitaires se sont déroulées comme en métropole.
C'est une antenne de l'Institut national de veille sanitaire -la CIRE- qui en est chargée.
La surveillance a été renforcée à partir de l'alerte de l'OMS du 24 avril 2009. Un dispositif initial a été mis en place, dans un contexte où l'on ne connaissait rien sur le virus. Ce dispositif est renforcé à partir du 23 juillet.
Les constatations sont précises : les statistiques collectées montrent que le pic de la grippe survient lors de la semaine 36.
Entre les semaines 30 et 38, on dénombre :
- 132 302 consultations en ville pour infections respiratoires aigues (IRA)
- 104 067 A(H1N1) symptomatiques
- 331 personnes hospitalisées
- 25 cas graves
-7 certificats de décès mentionnant cette grippe.
Des faits marquants sont mis en évidence :
- Cette épidémie est survenue en période habituelle de recrudescence de circulation du virus grippal.
- La rentrée scolaire n'a pas eu d'impact significatif sur la courbe épidémique.
- La grippe a eu un intensité modérée (elle a représenté 1,4 fois l'activité des médecins sentinelles en période de recrudescense saisonnière).
- La souche pandémique a été hégémonique par rapport aux autres souches de type A.
- Les taux de formes graves et de létalité sont faibles, mais concernent aussi des sujets jeunes.
- Le taux d'attaque est de 12,85 %, chiffre probablement sous-estimé car il ne prend pas en compte les prises en charge hospitalières, ni les asymptomatiques.
- Une deuxième vague liée à l'épidémie dans l'hémisphère Nord est possible, mais peu probable en l'absence de mutation virale.
3. Comme en métropole, les soins ont été organisés en deux phases, mais ont concerné plus de personnes
Au début de la pandémie, tous les patients suspects ont été hospitalisés et isolés, avant que ne se mettent en place des centres dédiés. A partir du 23 juillet, les patients ont été orientés vers les médecins de ville. Seulement les personnes présentant des formes graves ont été traitées en hôpital.
- La première phase a été la plus difficile, car il fallait tout à la fois surveiller, comprendre et réagir, dans un contexte où circulaient des virus de la grippe différents. Au début, la grippe B était dominante, puis l'on a observé des cas graves de H3N2 avant que le H1N1 finisse par l'emporter. La crainte de beaucoup était que les équipements hospitaliers n'aient pas la capacité d'accueil suffisante, ne fut-ce que quelques jours.
Le virus était mal connu. Les premiers cas étaient venus de l'Australie et du Canada. Le protocole appliqué a alors été calqué sur celui prévu pour le H5N1, qui prévoyait un signalement hospitalier, un isolement et une mise en quarantaine.
Les équipements disponibles avaient été prévus, et sont de qualité : à l'hôpital de Saint Pierre par exemple, le laboratoire est aux normes P3, avec sas et pression négative. La gestion des déchets est individualisée. C'est une performance dans un établissement ancien dont les pavillons à étage ne comportent même pas d'ascenseurs.
Les premiers cas ont pu être isolés correctement. Les prélèvements nécessaires ont été effectués, ce qui a permis de décider en fonction des résultats si le patient pouvait ou non sortir. Les conditions d'accueil à l'hôpital sont cependant critiquées, car de nombreuses chambres comportent trois lits.
Les médecins de ville ont critiqué cet « hospitalocentrisme », en rappelant qu'ils avaient fait face au chikungunia, dès le début.
- Lors de la deuxième phase, les hôpitaux ont distribué des masques à tous les médecins traitants.
Ceux-ci pouvaient prescrire du Tamiflu s'ils le souhaitaient, ce médicament étant disponible en pharmacie à partir de la fin août.
Une exception a été faite pour le Tamiflu pédiatrique, qui ne pouvait être prescrit que par les pédiatres de deux hôpitaux, ce qui a fait l'objet de critiques, du fait de la suractivité qui leur était imposée.
Sur les trois mois où la pandémie a été active, 2600 prélèvements ont été opérés. Ces prélèvements ont été analysés dans un premier temps en laboratoire P3, puis en P2. Le nombre de tests et de réactifs a été jugé suffisant.
- Sur ces deux phases, il n'y a jamais eu de surcharge des services des urgences qui étaient prêts et communiquaient régulièrement, toutes les semaines, avec l'InVS. Les équipements de réanimation ont été en nombre insuffisant pendant une période très courte. Le groupe hospitalier Sud Réunion a eu ainsi du mal à faire venir du matériel spécialisé de métropole (un ECMO, utilisé pour l'oxygénation extracorporelle) alors que l'EPRUS en avait en stock.
En trois mois, ont été dépensés à La Réunion 70 000 euros pour financer les réactifs du H1N1. Au début, les prélèvements ont été systématiques. Il était possible de traiter 75 prélèvements par jour, pas plus car il fallait les grouper et pouvoir analyser aussi les prélèvements qui ne concernaient pas le H1N1.
Puis les prélèvements se sont espacés, car ils n'ont pas de sens en phase épidémique, sauf pour les cas graves.
La difficulté du traitement des prélèvements tient d'une part à la nécessité de les grouper pour pouvoir les analyser, d'autre part à la nécessité de traiter aussi les autres virus grippaux.
Une seule patiente enceinte asthmatique négligée a eu la grippe qui l'a conduite à rester trois jours en réanimation. Aucune observation particulière n'a été faite sur les femmes enceintes.
Entre le 15 août au 20 septembre, de 13 à 20 % de la population a été repérée comme ayant eu la grippe. 4% des personnes infectées ont plus de 60 ans. Seuls 13 patients ont connu des formes graves, et 4 en sont décédés.
Les médecins ont largement remarqué que les masques étaient inadaptés. Ils ont estimé qu'ils ne pouvaient pas porter de masque FFP2, peu pratiques. Ces masques sont restés inutilisés à La Réunion, tant dans les cabinets médicaux que dans la rue ou à l'école.
Des retards ont eu lieu dans la distribution des masques aux cliniques. Les médecins généralistes ne les ont obtenus qu'au pic de l'épidémie. Les solutions hydro-alcooliques n'ont pas été disponibles en quantité suffisante.
Comme en métropole plus tard, les médecins libéraux et les professions médicales n'ont pas été associés à la définition des mesures à prendre. Ils ne pouvaient pas non plus vacciner en cabinet en décembre 2009 les Réunionnais qui souhaitaient se prémunir du virus avant d'aller passer les fêtes en métropole.
4. La vaccination est organisée depuis octobre de la même façon qu'en métropole.
La vaccination a commencé tôt, dès lors que les vaccins ont été disponibles. Elle a débuté mi octobre pour le personnel hospitalier. Elle a été étendue au public à partir du 20 novembre. Neuf centres de vaccination ont été ouverts sur la vingtaine qui avait été prévue. Les catégories prioritaires étaient connues, mais tous ceux qui voulaient se faire vacciner l'ont pu, même sans bon de vaccination, car peu de gens se sont pressé dans les centres.
Le nombre de vaccinés reste relativement faible (4000 à la mi-décembre), ce qui s'explique par l'absence de vaccins au moment où la pandémie se répandait, en juillet et en août. La demande de vaccination a été relancée en décembre par les « transhumants » qui souhaitaient passer les fêtes en métropole.
Le personnel hospitalier s'est fait peu vacciner (7 % en mi-décembre à l'hôpital de Saint Denis).
Les vaccins utilisés sont les mêmes qu'en métropole : le Pamdemrix, tout d'abord, puis le Panenza sans adjuvant, et le vaccin de Baxter pour les personnes allergiques à l'oeuf (qui doivent venir à l'hôpital).
Les dirigeants des hôpitaux soulignent qu'il a été difficile au sein de leurs établissements de mobiliser le personnel pour aller vacciner dans les centres de vaccination pilotés par la DRASS. Ils notent de vraies difficultés pour établir le planning général. Les volontaires étaient peu nombreux, notamment chez les internes.
La vaccination repartira peut-être lors des vacances scolaires de février, qui pourrait entraîner un deuxième pic de la pandémie, du fait des voyages.
5. Les leçons que tirent les Réunionnais de l'ensemble de cette période sont particulièrement intéressantes.
Certaines sont de portée générale, d'autres concernent plus particulièrement l'Outre-Mer.
Première leçon : La crise renvoie aux fondamentaux.
Les personnels hospitaliers ont fait particulièrement preuve de cohésion. Il y eu une véritable solidarité à l'intérieur des établissements. Les syndicats ont adhéré aux mesures prises. Il n'y a plus eu d'arrêts maladies. Ceux qui sont en arrêt maladie viennent travailler.
Deuxième leçon : Il serait utile d'établir une liste de personnels ciblés, ayant des compétences définies, et de constituer une réserve sanitaire spécialisée .
Cela permettrait de prévoir les spécialistes qui devront venir de métropole, en cas de besoin.
Troisième leçon : La consultation et la formation des médecins généralistes aurait dû être envisagée selon les modalités mises en place lors du H5N1 . Les médecins libéraux, les personnels infirmiers, et même les kinésithérapeutes, réunionnais, qui avaient dû se battre contre le chikungunia, avaient alors beaucoup travaillé sur le plan grippe aviaire La concertation mise en place avait alors permis de définir les besoins par secteur et par commune. Il avait ainsi été prévu qu'un lycée pourrait être transformé en hôpital de campagne. Une formation avait été organisée sur le virus de la grippe aviaire, sur les six phases du plan pandémie, mais aussi sur la conduite à tenir lors des différentes phases et des différentes alertes. Plusieurs réflexions avaient porté sur des éléments qui n'avaient pas été prévus dans le plan, comme ce qui se passerait en cas d'interruption des transports aériens et maritimes, en cas d'embargo ou d'un nombre très élevé de décès.
Une telle concertation dans le cas du H1N1, aurait permis d'impliquer les médecins libéraux dans la gestion de la crise, alors qu'ils se plaignent de ne pas avoir été prévenus des réunions destinées aux hospitaliers, d'avoir été mis devant le fait accompli, d'avoir été mis en situation d'attendre les directives ministérielles et de ne pas pouvoir être entendus.
Quatrième leçon : Les procédures de déclaration des incidents sont parfois inadaptées. Le système de traçabilité peut être amélioré. Actuellement, un généraliste qui observe des symptômes va devoir les relier à la vaccination. Il n'a pas de directive sur la conduite à tenir, même s'il sait qu'il doit joindre l'AFSSAPS dont le site est jugé inutilisable par les praticiens réunionnais, ou la CIRE. Mais ce système marche mal. Il reste nécessaire de remplir à la main un document qui doit être téléchargé, alors qu'aux Etats Unis, comme en Angleterre, la déclaration peut être faite en ligne, à partir d'un formulaire en ligne, le malade déclarant lui-même ses réactions.
Cinquième leçon : Il faut prévoir dans les hôpitaux des lits qu'on puisse rapidement armer avec du matériel de surveillance et de ventilation . Il faut pouvoir transformer rapidement des services en services de réanimation, ce qui suppose d'avoir du matériel disponible (éventuellement à la limite de l'obsolescence, mais vérifié), de définir une zone spéciale, d'identifier le personnel pouvant éventuellement travailler en réanimation et qui pourrait être formé de façon continue à la réanimation.
Sixième leçon : Il serait souhaitable que les populations françaises de l'hémisphère Sud puissent disposer du vaccin le plus adapté, qu'il soit français ou australien si ce dernier correspond mieux à l'état du virus, suite à mutation, lors d'une deuxième vague de pandémie. Cette question, qui relève du reste de la compétence de l'Agence européenne des médicaments et de la Commission européenne mérite d'être posée.
B - LA SITUATION EN GUYANE
Au niveau régional, le plan a été coordonné par un référent, le Docteur Laversane, qui suit l'application locale de ces dispositions.
1. A Saint Laurent du Maroni
Dans la semaine de fin janvier, le gymnase réquisitionné a été fermé. Les personnels infirmiers et le médecin qui y assuraient la vaccination sont revenus sur leur lieu de travail : le centre de santé CROIX ROUGE, où ils assurent toujours la vaccination. Cela leur facilite d'ailleurs le travail ; ils perdent moins de temps et assurent mieux leurs autres missions (tuberculose, SIDA).
On note, comme en métropole, des réticences sur les adjuvants (seulement chez les « métros » sensibilisés par Internet), et un gâchis de doses pour peu que le nombre de vaccinés ne soit pas multiple de 10.
Des particularités apparaissent : Les horaires ont été considérés comme inadaptés, car entre 14 h et 16 h chaleur est insupportable. Peu se sont déplacés. Tout le monde a été reçu, même sans bon de vaccination. Les bushinengués sont traditionnellement peu motivés pour la vaccination.
Des problèmes sont apparus lors des entretiens préalables : il n'y avait aucune confidentialité, trois accueillants n'appartenant pas au personnel médical ou paramédical étant assis côte à côte. Les langues locales n'étaient pas pratiquées, qu'il s'agisse du créole ou du saramaca. Les sauts de tension électrique étaient fréquents. Quand ils se prolongeaient, les vaccins étaient réchauffés et perdus.
2. A Apatou (sur le fleuve)
Beaucoup de doses ont été gâchées car il n'y avait pas eu de « publicité ». La vaccination a eu lieu le vendredi juste avant les vacances scolaires.
3. A Papaïchton (sur le fleuve)
Il y a eu à Maripasoula (1 h 30 de Cayenne en petit avion) et à Papaïchton (2 heures de pirogue en plus) une réelle alerte fin août, début septembre.
On a vu des records de 100 consultations par jour dont 40 enfants pour syndromes grippaux au centre de santé. Quatre infirmiers ont été malades. Il y a eu un décès (évacuation trop tardive) d'une femme immunodéprimée. Des masques ont bien été livrés.
Une équipe vaccinatoire est venue fin janvier, mais la population de Papaïchton n'avait pas été prévenue (en conséquence, il y a eu 8 vaccinés pour 4 000 habitants). L'équipe a laissé les vaccins sur place.
A Maripasoula, 100 personnes ont été vaccinées.
4. A Taluen
Près de Twenké, à 2 heures de pirogue vers le Sud, le centre de santé promis par le ministère n'a toujours pas vu le jour. Aucune personne n'a été vaccinée.
5. Remarques générales
De façon générale, s'est ajouté en Guyane un manque de prise en compte des particularités locales, particulièrement le long du fleuve, où il n'y a pas de voie terrestre de communication. On notera, en revanche, que toute personne se présentant a pu se faire vacciner (Haïtiens, Surinamiens,...).
TROISIEME PARTIE : LA NECESSAIRE PRISE EN COMPTE D'INTERROGATIONS LEGITIMES
De nombreux débats critiques sont apparus, souvent de manière spontanée, souvent sur Internet, dans le cadre de blogs ou de forums de discussion. D'autres se déroulent dans des structures plus classiques. Certaines remarques sont excessives, d'autres sont pertinentes.
Des premières réponses peuvent et doivent être apportées aux questions qui émanent de la société civile, des associations, des syndicats, de élus et même de plus en plus de citoyens qui tiennent à s'exprimer.
Ces questions portent essentiellement sur les techniques de production et la sécurité des vaccins, sur la durée des essais cliniques, sur l'information disponible, sur l'utilisation d'adjuvants et de conservateurs, sur le syndrome de Guillain Barré, sur les commandes passées par l'EPRUS.
I - LES TECHNIQUES DE FABRICATION DES VACCINS GARANTISSENT-ELLES LEUR FIABILITE ?
Prend-on suffisamment de précautions ? Peut-on faire confiance aux nouvelles techniques de production ? Les essais cliniques sont-ils suffisamment longs pour garantir la qualité des futurs vaccins ?
A - DE NOMBREUSES PRECAUTIONS SONT PRISES TOUT AU LONG DU PROCESSUS DE FABRICATION
La sélection d'un candidat vaccin est maîtrisée et de nombreuses précautions sont prises dans le cadre du processus d'autorisation de mise sur le marché
C'est le résultat du travail mené par 200 centres nationaux qui surveillent et récupèrent des virus, qu'ils transmettent à des centres mondiaux de référence, qui intègrent l'information au niveau planétaire, ce qui permet de sélectionner le candidat vaccin. L'OMS indique alors quel sous-type de virus doit entrer la combinaison vaccinale.
Plus précisément, comme l'a indiqué le professeur Lina lors de l'audition publique du 1 er décembre, ce sont les laboratoires essentiels de régulation de l'OMS qui vont modifier le virus pour le transformer en candidat vaccin, en supprimant tous ses caractères de virulence potentiels. Celui-ci sera alors transmis aux producteurs par l'OMS pour fabrication et distribution de doses vaccinales.
B. L'APPARITION DE NOUVELLES TECHNIQUES EST ENCORE TROP RECENTE POUR QU'ON PUISSE JUGER LEURS AVANTAGES ET LEURS INCONVENIENTS
Les vaccins sont fabriqués de plus en plus selon des techniques différentes dont certaines sont récentes.
1. La culture sur cellules se développe par rapport à la culture traditionnelle sur oeufs
Traditionnellement, les vaccins sont produits en introduisant le virus sélectionné dans des oeufs de poule fécondés. Les préconisations de l'OMS sont d'ailleurs prévues pour ce type de culture. Le virus s'y développe très rapidement.
Ainsi que l'indique de manière fort pédagogique Alain Perez dans Les Echos du 25 septembre 2009, « les néovirus sont ensuite séparés par centrifugation avant d'être inactivés. En fait, seules des protéines de l'enveloppe extérieure du pathogène sont conservées. Ces particules, véritable carte d'identité du virus, sont intégrées dans une solution qui devient le principe actif du futur vaccin. Après injection dans l'organisme, ces protéines de surface sont repérées par le système immunitaire et déclenchent la production d'anticorps spécifiques ».
Cette culture sur oeufs exige de disposer de quantités importantes d'oeufs. Elle peut entraîner certaines allergies chez les enfants.
C'est pourquoi de nouvelles techniques de production de vaccins à partir de cellules animales sont actuellement testées et utilisées. D'importants programmes de recherche sont en cours pour s'affranchir des oeufs. Les Etats-Unis y consacrent deux milliards de dollars. Un premier résultat va pouvoir être testé en temps réel, puisque Baxter vient de mettre sur le marché un vaccin préparé à partir de culture cellulaire.
2. L'utilisation d'un spray nasal paraît plus confortable que l'injection par piqûre, mais l'on manque encore de recul pour en apprécier les effets
Ce spray nasal est fabriqué à partir de virus qui ne sont plus inactivés.
Ce nouveau vaccin est fabriqué par la firme Medimmune qui a prévu d'en produire 40 millions de doses.
Le virus pourrait-il se réactiver ? Dans d'autres pathologies, on avait par le passé signalé des cas de contaminations fortuites de l'entourage. Il est encore trop récent pour que l'on puisse répondre à cette question qui interpelle les scientifiques. On ne peut que constater qu'il n'y a pas eu de problème particulier pour l'instant, dans un contexte où un grand nombre de personnes ont été ainsi vaccinées aux Etats-Unis.
C. LES ESSAIS CLINIQUES TIENNENT COMPTE DE L'EXISTENCE DE DONNEES ANTERIEURES
Lors de ces essais, on teste la tolérabilité, la réactogénicité, l'immunogénicité et la protection croisée.
Ces essais sont réalisés en tenant compte des résultats obtenus lors d'essais antérieurs faits avec des vaccins permettant de lutter contre des virus déjà connus.
Le cas du Pandemrix de GSK est particulièrement intéressant. La décision positive de l'Union européenne a été partiellement basée sur les données disponibles pour le vaccin Pandemrix avec l'antigène H5N1 qui avait déjà été accepté en Europe en mai 2008.
Ces données tenaient compte de plusieurs essais cliniques réalisés avec ce vaccin contre la grippe H5N1 : il était généralement bien toléré, ses effets secondaires étaient limités.
Ces données sont complétées par d'autres études : GSK mène maintenant 16 études cliniques avec 9000 personnes incluant des adultes en bonne santé, des personnes âgées et des enfants (dont des nourrissons) en Europe, au Canada et aux États-Unis avec son vaccin contre la grippe A(H1N1) adjuvanté.
II. L'INFORMATION DISPONIBLE SUR LES VACCINS EST-ELLE SUFFISANTE ?
De nombreuses informations sont disponibles, mais sont peu utilisables par les patients qui n'ont pas le choix de leur vaccin. Certaines frustrations en découlent.
A - LES CARACTERISTIQUES DES VACCINS SONT CONNUES
Dans l'Union européenne, l'EMEA publie les résultats des essais, d'une part en seize pages, d'autre part sous forme résumée de deux pages.
A titre d'exemple, l'encadré ci-après reprend la fiche de deux pages diffusée par l'EMEA pour le Celvapan, sous la référence EMEA/540117/2009 EMEA/H/C/982.
|
Celvapan Vaccin grippal pandémique (virion entier, dérivé de cellules Vero, inactivé) A/California/7/2009 (H1N1) Résumé EPAR à l'intention du public |
|
Ce document est un résumé du rapport européen public d'évaluation (EPAR). Il explique comment le comité des médicaments à usage humain (CHMP) a évalué les études réalisées afin d'aboutir à ses recommandations relatives aux conditions d'utilisation du médicament. Pour plus d'informations sur votre état ou votre traitement, veuillez consulter la notice (également comprise dans l'EPAR) ou contacter votre médecin ou votre pharmacien. Si vous souhaitez davantage d'informations sur la base des recommandations du CHMP, veuillez lire la discussion scientifique (également comprise dans l'EPAR) . |
|
Qu'est-ce que Celvapan? Celvapan est un vaccin administré par injection. Il contient des virus de la grippe qui ont été inactivés (tués). Celvapan contient une souche de grippe appelée A/California/07/2009 (H1N1)v. Dans quel cas Celvapan est-il utilisé? Celvapan est un vaccin destiné à protéger contre la grippe «pandémique». Il ne devrait être utilisé que pour la pandémie de grippe A (H1N1) qui a été officiellement déclarée par l'Organisation mondiale de la santé, le 11 juin 2009. Une pandémie de grippe survient en cas d'apparition d'une nouvelle souche de virus de la grippe susceptible de se propager facilement d'une personne à l'autre en raison de l'absence d'immunité (protection) des personnes contre cette souche. Une pandémie peut toucher la majorité des pays et des régions à travers le monde. Celvapan est administré conformément aux recommandations officielles. Le vaccin n'est délivré que sur ordonnance. Comment Celvapan est-il utilisé? Celvapan est administré par injection dans le muscle de l'épaule en deux doses, à au moins trois semaines d'intervalle. Comment Celvapan agit-il? Celvapan est un vaccin. Les vaccins sont destinés à «apprendre» au système immunitaire (les défenses naturelles du corps) comment se défendre contre une maladie. Celvapan contient un virus appelé A (H1N1)v qui est à l'origine de la pandémie actuelle. Le virus a été inactivé afin qu'il ne puisse plus induire de maladie. Lorsque le vaccin est administré à une personne, son système immunitaire reconnaît le virus inactivé en tant qu'«étranger» et fabrique des anticorps contre ce dernier. Lors d'une nouvelle exposition au virus, le système immunitaire sera capable de produire des anticorps plus rapidement. Cela constitue un moyen de protection contre la maladie. Les virus utilisés dans Celvapan sont mis en culture dans des cellules de mammifères («cellules Vero»), contrairement à ceux d'autres vaccins contre la grippe qui sont mis en culture dans des oeufs de poule. » Quelles études ont été menées sur Celvapan? Celvapan a tout d'abord été développé comme un vaccin « prototype » qui contenait une souche H5N1 du virus de la grippe appelée A/Vietnam/1203/2004. La société a étudié la capacité de ce vaccin « prototype » à déclencher la production d'anticorps (« immunogénicité ») contre cette souche du virus de la grippe préalablement à la pandémie. Suite au déclenchement de la pandémie actuelle, la société a remplacé la souche du virus dans Celvapan par la souche H1N1 à l'origine de la pandémie et a présenté les données relatives à ce changement au Comité des médicaments à usage humain (CHMP). Quel est le bénéfice démontré par Celvapan au cours des études? Il s'est avéré que le vaccin « prototype» obtenait des niveaux d'anticorps protecteurs chez au moins 70% des personnes faisant l'objet d'une étude. Conformément aux critères établis par le CHMP, ce résultat a démontré que le vaccin produisait un niveau approprié de protection. Le CHMP était également satisfait que le remplacement de la souche du virus par la souche H1N1 n'affecte pas les caractéristiques du vaccin. Quel est le risque associé à l'utilisation de Celvapan? L'effet indésirable le plus couramment observé sous Celvapan (chez plus d'une personne vaccinée sur 10) est une douleur au point d'injection. Pour une description complète des effets indésirables observés sous Celvapan, voir la notice. L'administration de Celvapan est déconseillée chez les patients ayant présenté une réaction anaphylactique (réaction allergique sévère) à l'un des composants du vaccin ou à l'une des substances présentes à l'état de traces (très faibles) dans le vaccin, telles que le formaldéhyde, la benzonase ou le sucrose. Cependant, durant une pandémie, il peut être justifié d'administrer le vaccin à ces patients, à condition que l'équipement médical de réanimation soit disponible. Pourquoi Celvapan a-t-il été approuvé? Le CHMP a décidé que, sur la base des informations obtenues concernant le vaccin « prototype » et des informations fournies sur le changement de souche, les bénéfices de Celvapan sont supérieurs à ses risques pour la prophylaxie de la grippe dans le cadre d'une situation pandémique H1N1 officiellement déclarée. Le comité a recommandé l'octroi d'une autorisation de mise sur le marché pour Celvapan. Celvapan a été autorisé dans des «circonstances exceptionnelles». Cela signifie qu'il n'a pas encore été possible d'obtenir des informations complètes sur le vaccin pandémique. Chaque année, l'Agence européenne des médicaments examinera toute information nouvelle éventuellement disponible et, le cas échéant, procédera à la mise à jour du présent résumé. Quelles informations sont encore en attente au sujet de Celvapan? La société qui fabrique Celvapan recueillera des informations relatives à l'innocuité et à l'efficacité du vaccin et les soumettra au CHMP pour évaluation. Quelles sont les mesures prises pour assurer la sécurité de Celvapan? La société qui produit Celvapan recueillera des informations relatives à la sécurité du vaccin durant son utilisation. Ces informations comprennent les données relatives aux effets indésirables du vaccin et à son innocuité chez les enfants, les personnes âgées, les femmes enceintes, les patients atteints de pathologies graves et les personnes présentant des troubles immunitaires. Autres informations relatives à Celvapan: La Commission européenne a délivré une autorisation de mise sur le marché valide dans toute l'Union européenne pour le vaccin « prototype » H5N1 Celvapan à Baxter AG le 4 mars 2009. L'avis positif concernant le vaccin H1N1 a été émis le 1er octobre 2009. L'EPAR complet relatif à Celvapan avec les informations les plus actualisées sur la manière d'utiliser le vaccin est disponible ici. Dernière mise à jour du présent résumé : 10-2009. |
B - LA COMPARAISON DES VACCINS DISPONIBLES RESTE CEPENDANT UN EXERCICE ENCORE TRÈS LARGEMENT INTELLECTUEL
1. Certes, tous les vaccins existants peuvent être présentés de manière synthétique
Les différents vaccins sont en effet produits par quelques entreprises, qui constituent un monde relativement fermé, et sont donc bien identifiées. Ces entreprises ont le plus souvent une approche mondiale et s'adaptent aux exigences des autorités sanitaires compétentes, soit nationales, soit européennes pour les pays membres de l'Union européenne.
LES LABORATOIRES ET LEURS VACCINS
|
Nom
|
Nom du vaccin |
Principaux pays de destination envisagés |
Propriétés du vaccin |
Volumes envisagés |
Dates importantes |
|
AstraZeneca (MedImmune) |
FluMist |
Etats-Unis |
Sans adjuvant Spray nasal (le seul) Réservé à certaines tranches d'âge |
Commandes pour 979 millions de dollars |
Livré le 4 octobre 2009 |
|
Baxter |
Celvapan |
France, Allemagne,
|
Sans adjuvant |
Commandes françaises de 50 000 doses |
3 novembre : Baxter annonce qu'il rend public son contrat avec la France |
|
CSL (entreprise australienne) |
Panvax®H1N1 |
Etats-Unis |
Avec adjuvant |
||
|
GlaxoSmithKline
|
Pandemrix |
France, Allemagne, Grande Bretagne, Belgique, Finlande, Canada, Mexique, Japon |
Avec adjuvant |
Commandes globales pour 1,5 milliard d'euros Commandes françaises de 50 millions de doses |
Approbation de la Commission européenne le 27 octobre 2009 |
|
Hualan Biological Engineering |
Chine |
||||
|
Novartis |
Focetria |
Union européenne |
Avec adjuvant Culture classique |
Commandes françaises : 16 millions de doses + 8 millions de doses en option Production totale d'ici fin 2009 : 100 millions de doses |
Approbation de la Commission européenne le 22 octobre 2009 |
|
Celtura |
Union européenne |
Avec adjuvant Culture cellulaire |
|
Nom de l'entreprise |
Nom du vaccin |
Principaux pays de destination envisagés |
Propriétés du vaccin |
Volumes envisagés |
Dates importantes |
|
Fluvirin H1N1 |
Etats-Unis |
Sans adjuvant |
|||
|
Omnivest |
Hongrie |
Avec adjuvant |
|||
|
Sanofi Pasteur |
Humenza |
Union européenne |
Avec adjuvant |
Commandes pour 400 millions d'Euros |
|
|
Panenza |
Sans adjuvant Destiné dans l'Union européenne aux populations spécifiques à risque |
||||
|
Vaccin pandémique A(H1N1) |
Etats-Unis |
Indiqué dès l'âge de six mois |
Commandes pour 190 millions de dollars dès le 25 mai |
AMM de la FDA le 15 septembre 2009 |
|
|
Sinovac |
Panflu.1 |
Chine |
Ces données sont néanmoins générales. Il n'existe pas de comparaison scientifique véritable de ces vaccins, de leurs effets, de leur efficacité. Les experts interrogés répondent généralement que ce serait « compliqué », et qu'il faudrait faire des études comparatives portant sur des milliers de personnes.
2. Mais dans la réalité, le patient n'aura pas la possibilité de choisir son vaccin
S'il est européen, il n'aura accès qu'aux vaccins autorisés en Europe, et donc essentiellement à l'un des vaccins adjuvantés. S'il est américain, il sait que son vaccin ne comportera pas d'adjuvant et qu'il peut choisir le vaccin en spray nasal.
S'il appartient à une catégorie prioritaire, il pourra éventuellement demander un vaccin sans adjuvant si celui-ci est prévu pour cette catégorie.
S'il appartient à la majeure partie de la population, il n'aura de fait aucun choix. Le vaccin qui lui sera administré sera celui disponible au centre de vaccination.
C'est l'une des sources potentielles de l'agressivité que l'on rencontre à l'égard de la vaccination dans une société où le consommateur est habitué à effectuer lui-même des choix, et où le patient entend partager la décision thérapeutique.
Au-delà des préoccupations sanitaires, le citoyen est aussi un contribuable, et le choix des livraisons du Pandemrix en 10 doses, provoquant du gâchis a été dénoncé, d'autant que le mélange par le praticien, sur place, appelait le contesté additif Thiomersal.
III. PEUT-ON SE PASSER DES ADJUVANTS ET DES CONSERVATEURS ?
A. L'UTILISATION D'ADJUVANTS EST UN CHOIX QUI PEUT ETRE DISCUTE TECHNIQUEMENT
Plusieurs adjuvants existent, selon qu'ils contiennent du mercure, de l'aluminium ou du squalène.
L'utilisation de tels produits est critiquée par certains qui craignent leur accumulation dans l'organisme.
Les études réalisées jusqu'à présent sur leurs effets sont peu nombreuses. Or ce serait important d'avoir des idées plus précises sur le niveau dangereux pour l'homme de la concentration de mercure, d'aluminium ou de squalène dans son organisme.
Les défenseurs des adjuvants font remarquer que beaucoup de vaccins couramment utilisés en contiennent déjà. Novartis utilise ainsi du squalène depuis douze ans dans tous ses vaccins contre la grippe. Plus de 40 millions de doses ont été produites avec cet adjuvant.
Il n'est pas nécessaire d'utiliser des adjuvants pour produire des vaccins, mais ces adjuvants présentent deux avantages : ils permettent de produire plus de vaccins avec la même quantité d'antigène. Ils augmentent l'immunité des patients.
La France a justifié son choix par la grande question d'une éventuelle pénurie de vaccins au plan mondial. Cette situation n'est pas exclue par les Américains qui pourtant n'ont jamais utilisé d'adjuvant dans leurs vaccins contre la grippe, qu'elle soit saisonnière ou pandémique.
La réponse à cette question dépend de plusieurs facteurs :
- de l'intensité et de la contagiosité de la grippe,
- du nombre de personnes qui souhaitent se faire vacciner,
- du nombre de doses nécessaires pour que le vaccin soit efficace,
- des méthodes de production des vaccins,
- de la longueur des essais cliniques,
- du délai nécessaire à l'Autorisation de Mise sur le Marché (AMM).
Ces facteurs n'ont pourtant pas été déterminants lors de la décision prise par l'Union européenne de n'autoriser que des vaccins avec adjuvants, alors que les Etats-Unis faisaient le choix inverse.
Dans les deux cas, les autorités sanitaires ont repris les dispositions qu'elles appliquent lors de la grippe saisonnière. La crainte que la grippe ne soit particulièrement sévère en Europe a sans doute joué un grand rôle dans la décision retenue par l'Union européenne.
B - L'UTILISATION DU THIOMERSAL EST DAVANTAGE CONTESTEE
Il s'agit d'un conservateur qui a pour objet de garantir l'absence de champignons et de bactéries, mais qui fait l'objet de nombreuses polémiques.
Son utilisation a été la conséquence d'un choix technique, lié à la distribution en dix doses, et à la nécessité de réaliser le mélange sur le lieu de vaccination au moment de la préparation des doses individuelles. La livraison en dix doses a été en France argumentée par l'éventuelle pénurie mondiale.
Il est nécessaire de mener des recherches rigoureuses sur les conséquences de son utilisation.
Les réticences à son égard proviennent de soupçons (non confirmés à ce jour) de liens avec des autismes de l'enfant, des risques de troubles neurologiques (mais pas à faible dose), et de l'accumulation de mercure dans les tissus.
Elles découlent aussi des prises de position de l'AFSSAPS et de leur évolution qui trouble certains.
L'AFSSAPS, le 4 juillet 2000, mettait en garde contre les effets potentiels du thiomersal :
« Le thiomersal est un composé contenant du mercure, utilisé depuis de nombreuses années comme conservateur dans les médicaments en particulier dans les vaccins. Une exposition répétée au mercure, par les aliments ou les médicaments, doit faire l'objet d'une attention particulière en raison de son accumulation potentielle dans différents organes.
Aux Etats-Unis, afin d'étudier l'éventuelle toxicité des faibles doses de mercure apportées par le thiomersal contenu dans certains vaccins, les CDC (Centers for Disease Control and Prevention) ont coordonné la réalisation de deux études épidémiologiques pour rechercher l'existence d'une association entre la dose cumulée de mercure apportée par les vaccins aux nourrissons dans les six premiers mois de vie et la survenue d'atteintes neurologiques et rénales. Les observations rapportées dans ces études n'ont pas permis de conclure à l'existence d'un risque associé au thiomersal, et de nouvelles études sont nécessaires.
L'Agence française de sécurité sanitaire des produits de santé (Afssaps) rappelle que par précaution l'Agence Européenne d'Evaluation des Médicaments (EMEA) a demandé en juillet 99 aux industriels de travailler au retrait du thiomersal utilisé comme conservateur dans les vaccins.
Dans une mise au point du 4 juillet 2000, le Comité des Spécialités Pharmaceutiques (CSP) de l'Agence Européenne d'Evaluation des Médicaments (EMEA):
1. a rappelé sa décision rendue publique le 8 juillet 1999 de promouvoir l'utilisation de vaccins ne contenant pas de thiomersal chez les nourrissons et les jeunes enfants,
2. a exigé que les laboratoires producteurs de vaccins soumettent leur plan d'action pour achever de retirer le thiomersal des vaccins,
3. a estimé que, pour la santé de la population générale et des enfants, le bénéfice de l'utilisation des vaccins contenant du thiomersal reste très largement supérieur au risque actuellement non démontré associé aux faibles doses de thiomersal,
4. a recommandé l'utilisation de vaccins sans thiomersal, quand ils étaient disponibles, pour la vaccination des nouveau-nés.
L'Afssaps s'associe à toutes ces positions et a demandé aux laboratoires de retirer au cours des prochains mois le thiomersal des vaccins concernés. Afin d'aider les prescripteurs, l'Afssaps précise en annexe, la liste des vaccins disponibles en France contenant ou non du thiomersal, et utilisés au cours de la première année de la vie. Ces informations sont consultables sur le site internet de l'Afssaps (afssaps.sante.fr).
Depuis lors, l'AFSSAPS a actualisé ses commentaires. Elle a publié en octobre 2009 les informations suivantes :
« Le thiomersal est un composé contenant du mercure qui est utilisé de longue date comme conservateur dans les médicaments, en particulier dans les vaccins. Il contribue à prévenir la contamination bactérienne des vaccins, et il est considéré à ce jour comme l'une des substances les plus efficaces pour cette prévention. Il a été également établi que le thiomersal contribuait à améliorer la stabilité des médicaments.
Ces propriétés sont particulièrement utiles dans le cadre de campagnes de vaccination où des conditionnements multidoses sont utilisés et où les doses ne sont pas administrées de façon immédiate et simultanée à plusieurs patients.
A la fin des années 90, une préoccupation est apparue, notamment aux Etats-Unis, à partir de l'hypothèse selon laquelle l'exposition précoce au thiomersal pourrait être associée à des déficits neuropsychologiques chez les enfants, ainsi qu'à des atteintes rénales.
Les études scientifiques effectuées pour éprouver cette hypothèse n'ont pas confirmé l'existence d'une association causale entre l'exposition précoce à cette substance et des problèmes neuropsychologiques ultérieurs en phase de pré-adolescence, notamment l'autisme (cf en particulier New England Journal of Medicines 27-09-2007).
L'Afssaps en France, l'Emea à l'échelon européen et l'OMS au niveau mondial ont évalué à plusieurs reprises cette question, depuis 10 ans. Ces analyses convergent pour considérer que l'existence du risque neurologique n'est pas établie au plan scientifique sur la base des études épidémiologiques existantes, sans que ces études permettent pour autant de l'écarter. D'un point de vue toxicologique, les vaccins contiennent des doses minimes de thiomersal, entre 0.003% et 0.01%, soit au maximum 25-50ug/dose. A ces doses, et dans la situation et les conditions d'emplois, tout risque de toxicité est a priori exclu.
Par ailleurs, le thiomersal est un allergène de contact, et on estime que 10 à 12 % de la population lui serait allergique. Des réactions allergiques après vaccination ont été rapportées dans la littérature, mais plus de 90 % des patients qui ont une allergie de contact au thiomersal ne développent aucune réaction allergique à l'administration du vaccin. Ces risques de sensibilisation sont mentionnés dans le résumé des caractéristiques du produit des vaccins concernés, et se rencontrent avec d'autres conservateurs.
Aucune étude relative à l'éventuel impact sur le développement embryonnaire et foetal en cas de vaccination de la femme enceinte n'est disponible. Des études montrent en revanche que l'exposition alimentaire, notamment via le poisson, au méthylmercure, moins rapidement éliminable dans l'organisme que l'éthylmercure produit par la métabolisation du thiomersal, ne présente pas de risque de toxicité pour la femme enceinte.
Dans une logique de précaution, les laboratoires producteurs de vaccins ont été incités par les agences française et européenne et par l'OMS à développer des vaccins uni-doses ne contenant pas de thiomersal en vue d'une utilisation en pédiatrie. Cependant les diverses évaluations des autorités sanitaires françaises, européennes et internationales convergent pour considérer que, compte tenu de ces propriétés en tant que conservateur indispensable dans les présentations de vaccins multi-doses, les bénéfices de l'utilisation du thiomersal l'emportent sur le risque toxicologique théorique ».
IV. FAUT-IL CRAINDRE LE SYNDROME DE GUILLAIN BARRE ?
Le syndrome de Guillain Barré a donné lieu à plusieurs travaux d'experts
Il entraîne en effet une paralysie rapide qui peut atteindre parfois les muscles respiratoires et les nerfs crâniens.
Comme toute atteinte neurologique pouvant aller du cas bénin et éphémère au cas grave et définitif, il fait particulièrement peur. En 1976, le nombre de cas qui sont apparus a été jugé trop élevé.
C'était certes à la suite d'une campagne de vaccination exceptionnelle, et certains ont établi un lien entre le nombre de ces cas et le nombre de personnes vaccinées (plus de 40 millions).
D'autres ont fait remarquer que ce syndrome apparaissait de manière régulière, et que les chiffres de 1976 étaient peu différents de la situation habituelle. Tout juste notait-on une concentration de certains cas pendant une certaine période. Mais dans la période suivante, le nombre de cas était moindre, et la situation moyenne était semblable à la normale statistique.
Une publication dans la revue américaine Langmuir , puis par le Journal of the Royal Society of Medicine en Septembre 1979, a mis en évidence ces données.
Enfin, la grippe elle-même peut engendrer des syndromes de Guillain Barré.
L'AFSSAPS donne les précisions suivantes dans une fiche d'octobre 2009 :
« La seule étude qui montre une augmentation du Syndrome de Guillain-Barré liée à une grippe confirmée par diagnostic sérologique est une étude française qui a estimé l'incidence à 4 à 7 cas pour 100 000 sujets grippés.
L'association entre la vaccination antigrippale et la survenue d'un Syndrome de Guillain Barré a été évoquée pour la première fois en 1976 aux Etats-Unis, lors de la campagne de vaccination contre le virus A/New Jersey/H1N1. Il s'agissait d'un vaccin à virus entier et sans adjuvant. Le risque attribuable à la vaccination dans la population des plus de 17 ans pendant les 10 premières semaines suivant la vaccination a été estimé à environ à 1 cas pour 100 000 vaccinés. Cependant, les expertises réalisées postérieurement n'ont pas établi de façon certaine de lien entre la survenue d'un Syndrome de Guillain Barré et la vaccination pratiquée à l'époque.
Depuis plusieurs études portant sur la vaccination antigrippale saisonnière ont été conduites, la plupart d'entre elles n'ont pas montré d'association. Seule une étude conduite qu'aux Etats Unis sur deux périodes de grippe saisonnière a mis en évidence un risque très faible d'environ un cas pour 1 million de vaccinés.
Le rapprochement entre l'ensemble de ces données suggère que le risque avéré de Syndrome de Guillain Barré découlant de la grippe est très supérieur au risque incertain de survenue d'un tel syndrome du fait de la vaccination » .
V. FALLAIT-IL PASSER DES COMMANDES AUSSI IMPORTANTES ?
1. La décision de commander un nombre aussi important de vaccins a été prise à un moment où l'on ne disposait pas de données sur l'ampleur de la crise
A-t-on pris trop de précautions, ce qui a conduit à des dépenses trop importantes ?
Les décisions ont été prises après des échecs dans la réactivité des autorités sanitaires par le passé (Katrina aux Etats-Unis, canicule en France).
Les autorités sanitaires ont été conseillées par des virologues et épidémiologistes plus que majoritairement fervents promoteurs des vaccinations. Elles ont craint que la pandémie ne soit très forte et que ses conséquences soient sévères, tant pour les individus que pour la société. Elles ont estimé préférable de commander un nombre important de vaccins, de masques, de tests, d'antiviraux afin de pouvoir écrêter le pic pandémique et de vacciner tous ceux qui le souhaiteraient. La situation a néanmoins été différente de ce qui avait été craint.
La pandémie s'est répandue de manière moins rapide que prévu. C'est heureux, car les autorisations de mise sur le marché dans l'Union européenne sont intervenues tardivement et plus tardivement qu'aux Etats-Unis. Le rythme de production des vaccins a de même été plus lent que prévu.
Il en résulte qu'une partie des vaccins ne sera pas utilisée, soit pour des raisons techniques (dépassement de la date de péremption), soit par faiblesse de la demande par rapport aux prévisions.
Une question importante doit cependant continuer de nous préoccuper : quelle situation aurions-nous dû gérer si la pandémie avait été plus grave et si le virus s'était répandu plus rapidement ?
Les sommes dépensées doivent en fait être comparées avec celles qui auraient été nécessaires en cas de forte pandémie. Ce raisonnement est certes inhabituel. Il peut être difficile à comprendre, mais c'est un raisonnement typique en santé publique.
L'impossibilité de connaître par anticipation la gravité de la pandémie permettait-elle de faire des choix plus souples et mieux adaptables dans le temps ?
L'observation des effets du virus sur l'hémisphère Sud ne permettait-il pas une vision moins catastrophiste des choses ?
2. La décision a été prise alors qu'on ne savait pas combien il faudrait de doses
Pendant plusieurs mois, les virologues ont estimé que deux doses seraient nécessaires, tout en menant des études pour savoir si cette hypothèse était correcte. Ces études ont porté sur la qualité de la réponse des anticorps, 21 jours après la vaccination, chez des sujets d'âge différent.
Le résultat de ces études a été connu courant septembre aux Etats-Unis : les essais cliniques montraient qu'une seule dose du vaccin produit par Sanofi Pasteur aux Etats-Unis était suffisante. Les autorités américaines ont attendu la fin du mois pour en tirer les conséquences. Les autorités européennes ne se sont prononcées que fin novembre, soit quatre mois après la date de passation des commandes de vaccins.
Ce résultat sur l'efficacité d'un vaccin à une dose a été confirmé par une étude menée parallèlement et indépendamment par l'Institut national de l'allergie et des maladies infectieuses, le NIAID, l'un des National Institutes of Health (NIH).
En Europe, Sanofi Pasteur a fait des essais comparables avec son vaccin adjuvanté Humenza. Les essais cliniques réalisés en France et en Finlande depuis le 18 août ont démontré qu'une seule dose de ce vaccin monovalent contre la grippe A(H1N1) induisait une forte réponse immunitaire chez les enfants de trois ans et plus, ainsi que chez les adultes.
QUATRIEME PARTIE : LA GESTION SOCIETALE D'UNE CRISE SANITAIRE DONT L'AMPLEUR ETAIT INCONNUE : VERS UNE NOUVELLE APPROCHE DE LA POLITIQUE DE SANTE PUBLIQUE ET DU DEBAT PUBLIC
Qu'a-t-on su ? A quel moment a-t-on eu conscience des inflexions qui pouvaient être apportées à la politique suivie ?
Sur quelle base les responsables ont-ils pris leurs décisions ? Comment ont-ils analysé et utilisé l'information disponible ?
I. EVALUER SEREINEMENT LA PREMIERE EXPERIENCE DE LUTTE CONTRE UNE PANDEMIE
Il faut maintenant prendre du recul et analyser la manière dont les pouvoirs publics ont réagi à la crise.
Il apparaît que les résultats de la politique engagée ne correspondent pas totalement aux prévisions et aux attentes des décideurs.
Aussi peut-on se demander si le plan pandémie grippale est adapté à une situation qui n'est pas aussi grave que celle imaginée lors de la grippe aviaire H5N1.
Pour répondre à cette question, il est nécessaire d'analyser les différentes étapes de gestion de la crise.
Trois étapes doivent être distinguées : la première correspond aux premiers mois de la pandémie ; la deuxième à l'organisation de la vaccination à partir de la fin de l'été 2009, à un moment où l'on pouvait tirer les leçons de l'expérience de la diffusion de la grippe pandémique dans l'hémisphère Sud ; la troisième au dépassement du pic pandémique, et à la normalisation de la situation à partir des premiers jours de janvier 2010.
La première a donné lieu à peu de critiques à l'époque, tant le contexte était nouveau. Les commandes de vaccins par l'EPRUS n'apparaissent pas excessives en juillet. Les critiques sur leur opacité surviendront bien plus tard.
La deuxième est celle qui prête le plus à débat, du fait des modalités retenues pour la campagne de vaccination.
La troisième, qui correspond à un retour à la normale, n'est pas encore terminée. Elle peut fournir l'occasion de dresser un bilan et de jeter les bases de la politique qu'il faudrait mener en cas de retour d'une telle pandémie, moins grave que celle imaginée lors du H5N1.
A - LES MESURES PRISES LORS DE LA PREMIÈRE ÉTAPE N'ONT PAS ÉTÉ, A L'ÉPOQUE, CRITIQUÉES
1. Chacun reconnaît que les décideurs ont dû faire face, dans l'urgence, à une crise nouvelle, qui pouvait être grave
Détecté le 24 avril 2009 au Mexique, le nouveau virus, appelé alors porcin ou mexicain fait très rapidement l'objet de positions très résolues de l'Organisation Mondiale de la Santé qui décide de mettre en oeuvre son niveau d'alerte 5, le niveau d'alerte maximale (niveau 6) sera déclenché le 11 juin.
Dès le 25 avril, l'alerte est déclenchée en France. Le virus est immédiatement analysé.
Il apparaît que l'on doit faire face à un virus nouveau, recombinaison de virus humain, porcin et aviaire, contre lequel il n'existait pas de vaccin. Contrairement au virus de la grippe aviaire qui ne se transmettait que d'animal à humain, ce nouveau virus, de la catégorie A(H1N1) se transmet d'humain à humain avec une grande contagiosité.
Les réactions à la nouvelle alerte sont marquées par la conscience d'un phénomène jugé particulièrement grave : des morts sont signalés au Mexique, près d'élevages porcins, et le lien est établi avec ce qui s'était produit deux ans auparavant avec la grippe aviaire. Plusieurs de ces morts restent inexpliquées.
Les mesures les plus drastiques sont étudiées, incluant quarantaine et interdiction de certains trafics aériens. Les patients présentant les symptômes décrits par l'OMS sont orientés vers les hôpitaux, et les premières analyses font apparaître que les cas les plus graves dépassent largement les populations traditionnellement à risque. Le nouveau virus s'attaque de manière particulièrement féroce aux moins de quarante ans. La mort est rapide. Elle résulte d'une pneumonie virale qui est fatale après cinq à sept jours, selon les données mentionnées par Mme Margaret Chan, directrice générale de l'OMS.
Une hypothèse est évoquée : les plus de quarante ans ont pu être exposés soit au virus de la grippe asiatique de 1957, soit à celui de la grippe de Hong-Kong de 1968.
La France envisage alors de mettre en oeuvre les dispositions qu'elle avait élaborées lors de la grippe aviaire, et qui sont largement décrites dans le plan national de prévention et de lutte « Pandémie grippale » mis à jour le 20 février 2009 par la Secrétariat général de la Défense nationale, à partir du document précédent qui datait du 9 janvier 2007.
Ce document traite de graduation de la réponse en cas d'alerte à la pandémie et de stratégie générale. Il fixe des principes de conduite opérationnelle de la crise, tout en rappelant les mesures de prévention et de lutte contre l'influenza aviaire (qui apparaissait comme le principal danger lors de sa conception).
2. Ces décisions font référence aux principes de précaution et de prévention
Les caractéristiques de la grippe apparue au Mexique sont troublantes : le virus A(H1N1), qui est analysé rapidement, peut être mortel. Il atteint en outre des populations généralement épargnées par ce type de maladie.
C'est la première fois qu'un virus se propage aussi rapidement sur plusieurs continents, notamment du fait des liens privilégiés entre le Mexique et l'Europe, et entre les Etats-Unis et la Grande Bretagne.
Dans une société mondialisée où l'information circule de manière quasi instantanée, l'annonce par l'OMS d'une pandémie à un niveau élevé dans un premier temps, puis au niveau maximum dans un deuxième temps, ne peut laisser aucun gouvernement indifférent.
Dans ce contexte, comme l'analyse fort justement M. Tabuteau, directeur de la chaire Santé à l'IEP de Paris, les pouvoirs publics sont tenus de prendre les dispositions nécessaires pour protéger la population d'un risque majeur. Notre société n'accepte plus - ce qui est légitime -que l'on n'agisse pas contre un risque annoncé si l'on en a les moyens.
Cette évolution résulte du passage de la médecine curative à la médecine préventive et de la mise en oeuvre des principes de précaution et de prévention (le premier s'applique lorsque le risque n'est pas identifié, le second quand il est avéré).
La France envisage d'interdire les vols vers le Mexique. Ses partenaires de l'Union seront plus circonspects.
C'est dans cet esprit qu'a été prise la décision de confier à l'EPRUS de commander aux laboratoires pharmaceutiques 94 millions de doses de vaccin, afin d'être en mesure de vacciner les deux tiers de la population, en deux fois. Deux doses de vaccin sont en effet recommandées par les virologues en cas de vaccin nouveau dont les effets sont inconnus, en l'absence de données précises sur l'impact du virus contre lequel on veut lutter.
Peu de voix dites « autorisées » se font entendre contre cette stratégie : le Professeur Bernard Debré le 26 juillet et le professeur Marc Gentilini le 6 août.
B. LA DEUXIÈME PHASE DEVRA ÊTRE ANALYSÉE AVEC SOIN
1. Les décisions prises de fin août à fin décembre 2009 sont davantage contestées
Fin août, on peut constater que la grippe a atteint moins de personnes que prévu en Argentine, en Australie, en Nouvelle Zélande, et, dans le cas dans la France métropolitaine, à La Réunion et en Nouvelle Calédonie.
Les spécialistes de la veille sanitaire savent alors que le taux d'attaque du virus a été de 10% en Argentine et non de 30 ou 40% comme on aurait pu le craindre. Ils savent aussi que 30 % des personnes hospitalisées en Australie ont eu besoin de soins intensifs, mais que le nombre de morts était moins élevé qu'annoncé, du fait de l'effet des antibiotiques et de l'aide apportée par les respirateurs aux personnes affectées par des infections respiratoires aigues. L'efficacité du Tamiflu a été prouvée, et que les résistances à ce médicament ont été peu nombreuses.
On observe également que, dans l'hémisphère Sud, les obèses et les personnes ayant un passé de difficultés respiratoires (dues à l'asthme, ou à l'immunodépression) ont davantage été sujettes aux formes graves de la grippe.
Or c'est à cette époque de la fin août que sont publiés les textes organisant la vaccination. Inspirés par le souci de vacciner les deux tiers de la population, ils sont dès leur conception trop rigides, puisqu'il est peu probable que le virus soit plus dangereux et plus virulent dans l'hémisphère Nord que dans l'hémisphère Sud.
2. Aurait-il alors fallu faire preuve de davantage de souplesse et d'adaptabilité ?
- N'aurait-il pas fallu alors prendre le temps de la décision, et profiter de la rentrée pour organiser un débat avec les professions médicales sur une mise en oeuvre adaptée, plus souple, plus évolutive du plan pandémie tel qu'il résultait de la réflexion sur la grippe aviaire ?
- N'aurait-il pas fallu, dès octobre, réviser les commandes faites aux laboratoires pharmaceutiques ? Les marchés passés le permettaient-ils ?
Il est vrai qu'il a fallu attendre fin septembre pour que les scientifiques américains disent de manière officielle qu'une seule dose de vaccin suffirait. Les autorités européennes ne l'affirmeront officiellement qu'après la mi-novembre.
Il était certes difficile de freiner le système mis en place alors que les autorités n'avaient pas de certitude sur la sécurité des médecins, sur la répartition des masques sur le territoire et sur l'utilisation correcte du Tamiflu sans dérapage de prescription.
- Ne fallait-il pas s'adapter aux réactions de la population qui considérait que la crise n'avait pas l'ampleur qui lui était présentée ?
Les sondages étaient éloquents, le ton des media également. Le constat qu'ils faisaient du caractère plus bénin du virus a donné des éléments de choix à de nombreuses personnes qui, a priori , n'étaient pas hostiles à la vaccination.
- N'aurait-il pas fallu, alors, revenir à une logique habituelle, au lieu de mettre en place un système relevant de l'exception ? De telles mesures ne sont acceptables aujourd'hui que si elles paraissent pleinement justifiées.
- N'aurait-il pas fallu gérer autrement le plan pandémie, en adaptant le niveau de réaction en fonction de l'évolution de la situation, en distinguant les mesures à envisager si la pandémie se révélait bénigne, tout en étant capable de relever le seuil de réaction en cas d'inquiétude sérieuse ?
- N'aurait-il pas fallu réassocier les professions médicales à la vaccination afin de davantage les motiver ?
Cela aurait sans doute facilité l'adhésion de la population et des professions médicales à la vaccination. Cela aurait permis d'éviter certaines rancoeurs liées à la réquisition.
- N'aurait-il pas fallu une approche pragmatique comme aux Etats-Unis où les autorités avouent que leur but était de convaincre les populations de la vaccination, et que le choix de se passer des adjuvants a été en partie construit sur la prise en compte de la défiance de la population ?
C. LE RETOUR À LA NORMALE FOURNIT L'OCCASION DE DRESSER UN BILAN ET DE PRENDRE DES DISPOSITIONS POUR L'AVENIR
1. Le retour à des modes de gestion habituels est survenu peu de temps après le franchissement du pic de pandémie
A partir du début de l'année 2010, une troisième étape se caractérise par un retour à la normale d'une grippe saisonnière : la ministre de la Santé qui prend acte du peu de motivation de la population, et de la réalité des chiffres qui correspondent à ceux de la grippe habituelle, décide de renégocier le nombre de vaccins commandés, de permettre aux médecins libéraux de participer à la vaccination et de mettre fin au système des bons de vaccination, qui paradoxalement arrivent à ce moment même dans la plupart des foyers, parfois en double exemplaire.
Le 13 janvier, le réseau Sentinelles communique sur la fin de la pandémie, ne mentionnant même pas l'éventualité d'un deuxième pic.
L'application du plan pandémie n'est pas formellement suspendue, mais ses dispositions exceptionnelles n'ont plus lieu d'être, même si par souci de précaution, les pouvoirs publics incitent toujours les Français à se faire vacciner et s'ils prévoient l'ouverture des centres de vaccination jusqu'à la mi-mars. Le débat change alors de nature : il ne porte plus sur l'organisation de la vaccination, mais sur l'opportunité des mesures prises au milieu de l'été.
2. C'est aussi le temps du bilan et des interrogations sur la nature des choix effectués
a) Les comparaisons internationales suggèrent que l'éventail des solutions possibles était très large
- Dans plusieurs pays comparables à la France, on retrouve des approches semblables : définition de plans ambitieux de vaccination ; définition de catégories prioritaires lorsque les vaccins ne peuvent pas être produits suffisamment rapidement ; mise à disposition de vaccins différents ; affirmation du caractère volontaire de la vaccination ; financements publics importants ; constitution de stocks de précaution.
Mais on relève aussi des choix différents, qui concernent notamment les techniques de production des vaccins (avec ou sans adjuvant, administrés par piqûre ou en spray) et surtout l'organisation même de la vaccination.
Les différences sont marquées entre l'Union européenne et les Etats-Unis, tant au niveau des choix effectués qu'à celui des procédures d'autorisation qui restent spécifiques.
Tant au sein de l'Union européenne qu'au niveau mondial, un certain nombre de pays ne se sont guère préoccupés de politique sanitaire, soit par manque d'intérêt, soit par manque de moyens.
De manière très rapide, on peut remarquer qu'en Grande Bretagne, a été menée une politique différente de distribution des médicaments, mais que l'on a assisté à des réactions semblables des infirmières, hostiles à la vaccination.
En Belgique, les médecins ont été à la fois vaccinateurs, prescripteurs et distributeurs de Tamiflu.
- La Chine elle-même s'est lancée dans une politique ambitieuse de production de vaccins.
La Chine a en effet prévu de vacciner 65 millions de personnes de septembre à la fin décembre 2009. Son vaccin, qui sera produit en 100 millions de doses jusqu'au premier trimestre 2010 par neuf laboratoires chinois, a été conçu en 87 jours à partir d'un essai clinique randomisé, en double aveugle, réalisé dès le 22 juillet dans sept provinces sur 13 000 personnes. Le vaccin dont on a observé des effets secondaires dans 11 % des cas, limite acceptée par l'OMS, a été autorisé début septembre par l'administration chinoise de contrôle des produits alimentaires et pharmaceutiques. Les résultats des essais cliniques ont été publiés dans The Lancet .
La vaccination est gratuite et facultative. Elle se révèle plus lente que prévu, la population manifestant des craintes par rapport au vaccin. Le plan de vaccination n'était de ce fait réalisé qu'aux deux tiers fin décembre 2009.
La Chine, qui souhaite bénéficier d'une reconnaissance internationale, s'appuie, comme les pays occidentaux, sur un dispositif de veille, d'alerte et de contrôle mis en place en 2003. Ce réseau national de surveillance comprend 411 laboratoires locaux et 556 hôpitaux.
Sept mois après le début de la pandémie, on recensait en Chine plus de 100 000 cas de grippe A(H1N1), et un peu plus de 300 décès qui ont surtout concerné les hommes pour 58 % des décès, les femmes enceintes pour 13,7 %, les personnes malades chroniques (47 %) et les obèses (18 %).
La Chine souhaite que son centre national sur la grippe, le CNIC, devienne centre mondial de référence pour la grippe de l'OMS.
- Les débats autour de la grippe pandémique ont été proches , qu'ils portent sur les adjuvants, sur le nombre de doses nécessaire, sur les effets secondaires, sur les précautions à prendre lors des essais cliniques, ou sur la manière de se faire vacciner. Il y a mondialisation du débat. Internet y joue un rôle central, avec un croisement de questions pertinentes (réelle dangerosité, indépendance des conseillers des autorités) et d'affirmations fausses (adjuvants responsables des Guislain B aux Etats-Unis en 1976, alors que les Etats-Unis n'ont jamais utilisé d'adjuvants dans leurs vaccins grippaux).
Mais l'opinion publique et les media n'ont pas réagi avec la même intensité dans les divers pays. Les Allemands sont restés sceptiques sur l'utilité de la vaccination. Les Suédois y ont par contre adhéré pleinement.
Ces quelques données très brèves montrent très clairement que l'on peut débattre de certains choix.
b) Ne faudrait-il pas préciser le plan pandémie, et envisager des phases intermédiaires moins drastiques ?
Cette question devra être résolue dans les prochains mois si l'on souhaite que le discours public sur la gravité d'une situation sanitaire puisse continuer à être entendu : comment définir un plan plus graduel, plus souple, plus évolutif, où le passage à un seuil d'alerte inférieur serait possible tout en indiquant que l'on reviendrait à une alerte plus forte en cas de besoin ?
c) N'aurait-il pas fallu confier un rôle plus important au ministère de la Santé dans le pilotage de la crise ?
- Les dysfonctionnements qui se sont produits n'auraient peut-être pas existé si le ministère de la Santé avait eu ce rôle, sous l'autorité du Premier Ministre.
En voici quelques uns :
Le séquençage de l'acte vaccinal, imaginé par le ministère de l'Intérieur fin août ne correspond pas aux règles respectées en matière de vaccination et d'actes de soins en général, où la même personne doit avoir une vision globale de l'acte.
Le côté aléatoire des rejets ou admissions de personnes sans bon dans les centres de vaccination a varié selon « l'autorité » du responsable du centre.
La demande par certains chefs d'établissements scolaires d'un certificat médical attestant de l'absence de grippe est tout aussi aberrante au vu du secret médical.
- Donner la priorité aux préoccupations sanitaires permettrait par ailleurs de réfléchir à la manière dont on pourrait prévenir les personnes qui devraient appartenir aux catégories prioritaires pour la vaccination. Une étude devrait être menée avec la CNIL pour savoir dans quelles conditions les données existantes sur la prescription de ventoline peuvent permettre de contacter les asthmatiques. Une réflexion semblable pourrait être menée pour des personnes à risque pouvant être identifiées par l'utilisation de médicaments spécifiques.
- Ne faudrait-il pas imaginer un dispositif plus resserré, une Task Force à la française, pilotée par le ministère de la Santé ? La question mérite d'être posée.
Cette Task Force serait notamment chargée d'identifier les réponses à apporter aux inquiétudes et aux réticences de la population, et de gérer une communication plus dynamique et plus interactive.
II. GARANTIR LA TRANSPARENCE DES DECISIONS ET DE LA GOUVERNANCE DE LA CRISE
La société est plus exigeante sur la gouvernance et le débat public
A l'issue de cette pandémie, nos concitoyens s'intéressent particulièrement à deux questions : la transparence des contrats passés entre l'Etat et les laboratoires pharmaceutiques ; les conflits d'intérêts éventuels des experts employés par les décideurs.
A. LE DEBAT SUR LA TRANSPARENCE DES CONTRATS PASSES ENTRE L'ETAT ET LES LABORATOIRES PHARMACEUTIQUES
1. La question apparaît à partir de septembre
En juillet, elle n'avait pas fait l'objet de débats particuliers. En septembre, des questions sont posées à l'Assemblée nationale sur les contrats passés entre l'Etat et les laboratoires pharmaceutiques. Ces questions sont relayés par l' hebdomadaire Le Point qui dénonce, dans son édition du 29 octobre 2009, l'opacité entourant les commandes de vaccins et saisit la commission d'accès aux documents administratifs (la CADA).
Cette commission décide que ces contrats doivent être rendus publics, à l'exception de certaines de leurs dispositions relevant du secret industriel et commercial.
2. La décision de la CADA entraîne la publication des contrats jusqu'alors confidentiels
a) La ministre de la Santé et des Sports en tire les conséquences et publie un communiqué, le 28 octobre 2009 :
« Un article de l'hebdomadaire Le Point, à paraître demain, porte un regard critique sur l'acquisition des vaccins contre le virus pandémique A(H1N1) décidée par le gouvernement.
Les journalistes, auteurs de cet article, omettent néanmoins de rappeler les éléments suivants, qui viennent contredire nombre de leurs allégations :
• les vaccins ont été commandés au mois de juillet, sur la base d'un avis du Haut conseil de la santé publique (HCSP) du 22 juin 2009 ;
• ces commandes ont toujours fait l'objet d'une communication publique, régulière, détaillée et exhaustive ;
• dès que les contrats ont été affermis, le gouvernement a, au cours de nombreuses conférences de presse, annoncé le nombre de doses commandées et les montants investis ;
• en outre, ce sujet a été présenté dans le détail aux parlementaires au cours de deux auditions de la ministre de la santé et des sports, le 16 septembre à l' Assemblée nationale et le 29 septembre au Sénat , en présence du sénateur François Autain, précisant à cette occasion les prix unitaires des vaccins achetés.
La Commission d'accès aux documents administratifs (CADA) ayant statué par avis en date du 15 octobre 2009, les contrats relatifs à ces commandes seront désormais transmis à toute personne morale en faisant formellement la demande au ministère en charge de la santé, dans le respect de la loi du 17 juillet 1978 et des dispositions de son article 6.
Les éléments scientifiques avancés sur les vaccins et le virus sont en outre souvent erronés :
• le passage à une injection, s'il devait être recommandé par les autorités sanitaires européennes, ce qui n'est pas le cas dans le dernier avis de l'agence européenne du médicament en date du 23 octobre , ne concernerait vraisemblablement pas la totalité de la population, les enfants et les personnes présentant des facteurs de risque restant très vraisemblablement soumis à une vaccination à deux injections pour une protection complète et pérenne. Les 94 millions de doses acquises, auxquelles il faut retrancher les 10 % qui seront données à l'OMS, ne permettront donc en aucun cas d'immuniser 94 millions de personnes ;
• les dernières données épidémiologiques (cf. point de situation épidémiologique InVS du 28 octobre consultable sur le site internet de l'InVS , notamment en Amérique du Nord, viennent enfin contredire les assertions relatées dans cet article et auraient dû inciter à davantage de prudence. »
b) Le laboratoire Baxter décide alors de lever la confidentialité de son contrat avec l'Etat
C'était nécessaire car la CADA estimait qu'il fallait le consentement préalable du laboratoire tel que prévu dans l'article 17 du marché conclu avec lui.
Baxter prend alors l'initiative d'indiquer qu'il a reçu commande de 50 000 doses pour un prix de 10 euros hors taxe par dose. Ce prix est plus élevé que celui payé aux autres fabricants, mais son vaccin, le Celvapan est particulier.
12 000 doses doivent être livrées fin août. Le reste doit être livré avant la fin de l'année.
L'AFP, qui commente les déclarations de Baxter, relève que le contrat :
- précise que la survenance d'effets indésirables ou inattendus ou le manque d'efficacité ne constitueront pas une violation de la garantie,
- prévoit qu'en contrepartie de ce marché, l'EPRUS s'engage à acquérir les 150 000 doses de vaccin Neisvac - un vaccin contre la méningite C -, conformément aux termes d'un autre marché, pour livraison avant le 15 décembre 2009.
c) Les données sur les commandes sont désormais publiques
Les contrats indiquent que l'EPRUS a passé commande de
- 50 millions de doses auprès de GSK,
- 16 millions de doses auprès de Novartis,
- 28 millions de doses auprès de Sanofi -Pasteur,
- 50 000 doses auprès de Baxter.
N'aurait-il pas été préférable de publier ces données spontanément, dès juillet ? Etait-il vraiment impossible pour l'Etat d'indiquer aux laboratoires que le nombre de doses et leur prix n'entraient pas dans le champ des données confidentielles ?
B. LE DÉBAT SUR LES CONFLITS D'INTÉRÊTS ÉVENTUELS DES EXPERTS EMPLOYÉS PAR LES DÉCIDEURS.
La question, largement médiatisée, a entraîné deux réactions de l'OMS.
Les media ont en effet publié plusieurs articles sur les rémunérations perçues par certains experts qui conseillent les décideurs, rémunérations provenant de laboratoires pharmaceutiques. Ils ont aussi largement commenté les liens entre ces experts et les laboratoires pharmaceutiques, au cours de leur carrière.
L'OMS, particulièrement visée, a répondu en deux temps.
1. La première réaction de l'OMS en date du 22 janvier 2010
Face aux critiques portant sur la présence auprès de la Directrice générale de l'OMS de conseillers ayant travaillé auparavant pour des laboratoires pharmaceutiques, l'OMS a publié le 22 janvier 2010 la déclaration suivante :

2. Une nouvelle déclaration lors d'une réunion au Conseil de l'Europe
L'OMS a, le 26 janvier 2010, publié un second communiqué. En voici un extrait concernant d'éventuels conflits d'intérêt, tiré de la déclaration du docteur Keiji Fukuda au nom de l'OMS à l'occasion de son audition au Conseil de l'Europe sur la grippe pandémique H1N1 :
|
INDUSTRIE PHARMACEUTIQUE Récemment, des accusations ont été portées selon lesquelles la politique et les recommandations de l'OMS étaient influencées par l'industrie pharmaceutique. Une des fonctions principales de l'OMS, qu'elle prend très au sérieux, est de donner des avis indépendants aux États Membres. L'OMS se garde de subir l'influence de tout intérêt indu. Je tiens à préciser ici clairement ce qui suit: la politique et les mesures recommandées et prises par l'OMS n'ont pas été indument influencées par l'industrie pharmaceutique. L'OMS reconnaît que la coopération mondiale avec des partenaires divers, dont le secteur privé, est essentielle pour relever du mieux qu'elle peut les défis de la santé publique, aujourd'hui comme demain. Il existe de nombreux garde-fous pour gérer les conflits d'intérêts, réels ou perçus, au sein des groupes consultatifs et des comités d'experts de l'OMS. Les conseillers spécialisés remettent à l'OMS une déclaration d'intérêts signée qui expose en détail toutes les éléments professionnels ou financiers qui pourraient nuire à l'impartialité de leurs avis. L'OMS prend très au sérieux toute allégation de conflit d'intérêts et elle a toute confiance dans l'intégrité et la validité scientifique de son processus décisionnel pendant la pandémie de grippe. Le 3 décembre 2009, elle a diffusé sur son site web des explications sur la manière dont elle utilise les organes consultatifs pour réagir à la pandémie de grippe. |
Plus généralement ce débat interroge le financement des structures de décisions, de veille, d'expertise, de recherche.
Quand il y a imbrication des financements (l'OMS par exemple donne gratuitement les souches de référence aux industries pharmaceutiques, mais celles-ci contribuent à son budget), il est indispensable que des chartes, des protocoles, des déclarations d'intérêts liés, et l'éloignement des personnes trop impliquées donnent des gages aux citoyens que les diagnostics et décisions ont été édictés dans l'intérêt général, et non pour le bénéfice de quelques uns.
Dans le cas de la France, il a été voté dans le Grenelle de l'environnement (phase 1) la mise à l'étude d'une « instance spécifique de l'expertise, garante de l'indépendance des protocoles, médiatrice en cas de résultats contradictoires, et recours pour les lanceurs d'alerte ». Gageons que si celle-ci avait été fonctionnelle avant les arbitrages sur les vaccins, le climat aurait été plus serein, tant pour la population, que pour les chercheurs soupçonnés.
III - S'INTERROGER SUR L'ACCEPTABILITE DES CHOIX DE SANTE PUBLIQUE
L'adhésion de la population à une politique est aujourd'hui fondamentale. L'exemple de la vaccination contre le virus A(H1N1) le montre bien.
Les pouvoirs publics doivent s'adapter à ce nouveau contexte, et trouver de nouveaux moyens pour que la société civile puisse s'exprimer dans le débat préalable, et pour mieux communiquer avec elle. Prendre des décisions ne suffit plus, encore faut-il qu'elles soient partagées et acceptées. Si ces décisions ne comportent pas d'obligation, ce qui est le cas pour la vaccination qui reste une décision individuelle, les pouvoirs publics devront faire particulièrement preuve de persuasion.
Ce n'est pas facile, car la société a changé depuis trente ans dans son rapport à la maladie, à la médecine et à la prévention.
A - LA SOCIÉTÉ A ÉVOLUÉ DANS SES ATTENTES ET SA MANIÈRE DE COMMUNIQUER
1. Cette évolution est perceptible depuis une trentaine d'années
Elle s'est produite en plusieurs phases.
- Il y a tout d'abord eu le tournant des années quatre-vingt.
Jusqu'au début des années quatre-vingt, la politique sanitaire est basée sur l'obligation : obligation de déclaration ou de vérification (syphilis), parfois de vaccination.
Les autorités communiquent peu sur les dangers d'une épidémie grippale (cas de 1957 et de 1968), malgré le nombre de morts.
- A partir de la propagation du virus HIV, le contexte change.
L'apparition du Sida a modifié les réactions et les attentes de la population, mais aussi la manière d'aborder les questions sanitaires. Les politiques de santé publique sont perçues différemment.
Il n'y a plus d'obligation de déclaration. L'obligation vaccinale est perçue comme une atteinte aux libertés individuelles.
- Un nouveau tournant a pu être constaté au début des années 2000.
Le SRAS et le H5N1 ont renforcé les effets du VIH, car les personnes qui en étaient atteintes étaient en danger de mort. Le sentiment global de vulnérabilité s'est accru.
Des erreurs d'appréciation, des retards, des mensonges ont rompu la confiance : amiante dite inoffensive en « usage contrôlé », nuage de Tchernobyl nié, interdiction de quatre ethers de glycol retardée.
Le H5N1 va entraîner de nouvelles interrogations et conduire à l'élaboration du plan pandémie. L'idée se répand qu'il faut se préparer à l'apparition d'un virus à la fois contagieux et dangereux, et qu'il faut donc élaborer dès maintenant la riposte, quitte à limiter éventuellement les libertés publiques. C'est le sens du plan pandémie de 2007 qui fait suite aux réflexions sur la grippe aviaire.
Parallèlement, certaines maladies qu'on sait mal traiter se développent sur certains territoires, comme le chikungunia. La perception de la médecine change : elle ne permet pas forcément d'éviter une mort prématurée.
La société réagit en souhaitant la mise en oeuvre du principe de précaution, même si celui-ci n'a de valeur constitutionnelle que dans le domaine de l'environnement. Le principe de prévention qui s'applique lorsque le risque est avéré a des implications proches. La jurisprudence s'en est déjà inspirée.
Ce processus n'en est qu'à son début. Il n'est du reste pas exempt de contradiction car les citoyens qui souhaitent plus de protection n'en acceptent pas forcément les contraintes qui en découlent. Ils sont par ailleurs critiques devant le coût de mesures de protection qui seront souvent jugées excessives si elles sont suivies d'effet.
La situation est donc paradoxale : la politique de prévention a pour objectif d'éviter des dérapages. Si ceux-ci sont contenus, elle a réussi, mais son coût est jugé trop élevé. Dans l'idéal, les frais engagés doivent en fait être comparés à ceux qui découleraient d'une situation non maîtrisée. Dans la pratique, un équilibre doit être trouvé entre prévention et acceptation d'une part de risque.
Il faut en tenir compte, d'autant plus que les modes traditionnels de communication ont eux-mêmes évolué.
2. La communication a changé de dimension
Si le contexte est nouveau, la communication est devenue quasi-immédiate. La décision est propagée instantanément, sur des supports démultipliés par Internet.
Il n'y a plus besoin de publier un texte sous une forme papier traditionnelle pour qu'il soit connu. Dès qu'il est rédigé et adopté, il devient immédiatement disponible, sans aucun frais, sur le réseau.
La communication est multiple : institutionnelle, informelle, citoyenne, mais aussi incontrôlée et incontrôlable.
La communication institutionnelle est omniprésente : elle concerne tous les acteurs d'une certaine taille : les pouvoirs publics, les instituts de recherche, les entreprises. Elle se développe sur des sites Internet, lors de colloques et dans les media, lors de reportages, d'interviews ou d'éditoriaux. Elle se poursuit par des affiches.
La communication informelle est tout aussi dynamique, sinon plus. Grâce aux possibilités offertes par Internet, les questions controversées acquièrent une audience immédiate sur les blogs et les forums de discussion.
Parallèlement, les informations disponibles deviennent difficiles à évaluer. Elles doivent systématiquement être croisées, recoupées, vérifiées pour qu'on soit assuré de leur origine, de leur fiabilité et de leur valeur.
Il en résulte une situation où il est difficile de distinguer les faits des opinions. Des acteurs inconnus dont il est difficile de vérifier la compétence acquièrent une visibilité qu'ils n'auraient autrement jamais eue. Les rumeurs s'en nourrissent.
Dans cet environnement, les erreurs et les insuffisances de la communication institutionnelle ne sont plus admises.
B - LES MODES DE GESTION PUBLIQUE ET DE COMMUNICATION INSTITUTIONNELLE DOIVENT S'ADAPTER À CETTE ÉVOLUTION
Dans ce brouhaha, la communication publique doit être évolutive, et tenir compte des changements de situation. Elle doit aussi être plus dynamique.
1. C'est nécessaire car le message public n'a pas été reçu de la façon dont l'espéraient les dirigeants de la politique sanitaire
a) Le discours officiel était pourtant élaboré et rationnel
- Il a reposé tout d'abord sur une volonté très claire de prévenir une crise sanitaire majeure.
La communication a donc porté sur la gravité potentielle du virus A(H1N1), en relayant les informations diffusées par l'OMS.
Elle a décliné les mesures envisagées par le plan pandémie grippale et formalisées par diverses circulaires ministérielles.
Les enjeux étaient de taille. Il fallait tout à la fois protéger la population contre la grippe, éviter la désorganisation de l'économie, écrêter le pic de la pandémie, s'inspirer des principes de précaution et de prévention et éviter une saturation éventuelle du système de santé.
Un effort particulier a été fait pour informer les Français des mesures barrières envisageables, et pour les amener à adopter de nouveaux comportements d'hygiène.
- Le discours a ensuite présenté de manière continue l'importance de l'acte vaccinal.
Cet acte est présenté comme la meilleure manière de se protéger contre un danger qui pourrait être grave.
Ce discours est encore celui tenu aujourd'hui par la Ministre de la Santé.
b) Ce discours n'a cependant pas été entendu
- Les professionnels de santé n'y ont pas adhéré, pour la plupart, ce qui a surpris les décideurs.
Beaucoup de professionnels ont, très tôt, refusé la vaccination. Un sondage Ipsos réalisé en septembre 2009 pour le Quotidien du Médecin faisait apparaître qu'à peine 50 % des médecins libéraux se disaient prêts à se faire vacciner. Cette réalité était confirmée en octobre où il apparaissait que sur 4100 infirmières consultées par le Syndicat national des personnels infirmiers (SNPI), 65 % refusaient la vaccination.
Plusieurs témoignages suggèrent néanmoins un changement d'attitude des personnels des centres de réanimation lorsqu'ils ont été confrontés à des cas graves.
Ces réactions de rejet sont dues pour partie à l'exclusion des personnels médicaux de la vaccination en mode libéral. Mais cette explication reste partielle.
Elles tiennent aussi à l'absence d'information spécifique des médecins et des infirmières qui étaient consultés par leurs patients et qui n'étaient pas associés aux dernières données scientifiques, et ne disposaient pas d'autres éléments récents d'information que ceux qu'ils avaient entendus à la télévision et à la radio.
Les besoins d'information et de participation des professionnels de santé ont été sous-estimés : les personnels médicaux sont en fait sous-informés des décisions ministérielles et surtout de leur logique et des choix qui les sous-tendent. Leur adhésion aurait été plus grande s'ils avaient eu l'impression de participer à une politique partagée.
- La population n'a pas suivi les recommandations des autorités sanitaires sur la vaccination, contrairement à leurs attentes
La perception du risque par la population n'a pas correspondu aux prévisions des autorités sanitaires.
Les citoyens, très rapidement, ont estimé que le virus n'avait pas le niveau de gravité qui leur était annoncé. Le dispositif mis en place était alors inadapté par rapport à leurs réactions.
Plusieurs enquêtes suggéraient dès la fin septembre que 60 à 65 % des Français n'avaient pas l'intention de se faire vacciner. Mi octobre, ce pourcentage avait augmenté, seuls 17% de nos compatriotes manifestant le désir d'être vaccinés.
Ces réticences à la vaccination n'ont pas été propres à la France.
Aux Etats-Unis, selon une étude réalisée par la Harvard School of Public Health avant le début de la vaccination, 40 % des adultes étaient sûrs de se faire vacciner, mais certains soignants intentaient une action en justice contre la vaccination « forcée ». Seul un parent américain sur deux entendait faire vacciner ses enfants.
En Allemagne, la population n'a de même pas cru à la nécessité de se faire vacciner. En Suède, par contre, la population s'est fait majoritairement vacciner.
2. D'autres messages et d'autres formes de communication devront être mis en oeuvre lors de la prochaine pandémie
- Il importe tout d'abord de tirer les leçons de ce qui s'est passé d'avril 2009 à février 2010.
Les messages publics n'ont pas suffisamment tenu compte de la perception de la réalité par la population.
Ils n'ont pas permis d'éviter des réactions de déni et de rejet.
Ils ont probablement eu un temps de retard par rapport à l'évolution de la pandémie, dans un contexte où l'information produit des effets immédiats.
Aucune esquisse de débat public n'a été tentée.
- La prise de décision et la communication doivent être conçues de manière plus moderne
L'exemple des Etats-Unis, décrit dans le chapitre VI, est particulièrement éloquent : la communication publique y est envisagée de façon totalement nouvelle, en s'appuyant sur les nouvelles technologies.
Plus de soixante personnes en sont chargés aux CDC d'Atlanta. Ce personnel de haute qualification analyse systématiquement le contenu des blogs et des forums de discussion sur Facebook, Twitter et autres sites de ce type. Leur objectif est de répertorier les arguments utilisés et de percevoir les évolutions des discours afin d'élaborer les réponses publiques possibles.
Ce travail d'anticipation est absolument remarquable. Il permet de distinguer les arguments rationnels des thèses irrationnelles (or celles-ci fleurissent, qu'elles soient a-scientifiques ou qu'elles relèvent des théories traditionnelles du complot). Il permet d'identifier les craintes ou les questionnements qui peuvent être légitimes (notamment sur la vaccination ou sur les vaccins).
Il serait intéressant de s'en inspirer, car si la vaccination n'est pas obligatoire, et si le ministère la juge nécessaire, il doit se donner les moyens de créer l'adhésion et convaincre la population de son bien-fondé, en trouvant les arguments qui correspondent à la réalité du risque.
Si la France est un pays qui est profondément marqué par l'approche pasteurienne, les ligues anti-vaccinales y sont traditionnellement actives. Le message public doit donc être subtil. Il devrait être davantage élaboré. Il pourrait être plus ciblé en fonction des différentes réactions possibles de diverses catégories de population. Il devrait surtout résulter du travail d'un nombre beaucoup plus important de spécialistes de la communication.
C. L'ORGANISATION DE DEBATS CITOYENS PERMETTRAIT DE MIEUX DEFINIR CE QUE DEVRAIT ÊTRE LA POLITIQUE DE SANTÉ PUBLIQUE
1. Cette approche est de nature à réconcilier les citoyens et les experts
M. Tabuteau en est l'un des promoteurs. Il a ainsi pris l'initiative de lancer des réunions d'information dans les institutions où il travaille.
D'autres l'ont suivi. C'est ainsi que des débats ont été organisés dans des grandes entreprises pour rendre leurs employés conscients des effets de la grippe et des activités essentielles qu'il faudrait préserver en cas de fort absentéisme.
Ces débats peuvent s'appuyer sur les travaux d'universitaires qui ont décidé de se regrouper pour être plus efficaces.
C'est ainsi que la Chaire de Santé de l'IEP de Paris, l'École des Hautes Etudes en Santé Publique (EHESP), son centre d'analyse des politiques de santé publique et l'Institut de Droit et Santé de l'Université de Paris-Descartes ont uni leurs efforts pour créer un pôle santé.
Les financements viennent à la fois de l'université, de contrats et d'études de recherches, des collaborations qu'elles peuvent avoir et des soutiens de partenaires institutionnels. Ce sont des financements pérennes pour certains et très ciblés pour d'autres.
2. Les thèmes de débat sont nombreux
Les citoyens comprennent mal la manière de penser des spécialistes des politiques de santé publique.
Ils comprennent mal les méthodes d'évaluation d'une pandémie. Les calculs fondés sur la surmortalité et non sur la constatation des décès leur paraissent très théoriques.
Ils s'interrogent sur la vaccination : dans quel cas est-elle nécessaire ? Quels sont ses avantages par rapport à ses effets secondaires éventuels ? Quelle est son sens : est-elle un geste civique et collectif, ou doit-elle rester dans la sphère des choix individuels ?
Le champ du débat est donc vaste. Il pourrait s'étendre plus globalement à l'élaboration d'une politique de santé adaptée aux nouveaux défis du XXI ème siècle. Il pourrait aussi porter sur la gestion et l'acceptabilité des risques sanitaires majeurs par notre société et sur la légitimité des politiques publiques.
De tels débats permettraient de réconcilier scientifiques et citoyens, autour d'arguments rigoureux, éventuellement critiques mais sereins, où l'on fera la part de ce qui est connu de ce que l'on ne connaît pas, et où l'on mettra en évidence ce qui relève du débat contradictoire et démocratique, dans un univers incertain.
CINQUIEME PARTIE : L'ACTION DES INSTITUTS DE RECHERCHE
I. UN FOISONNEMENT D'ORGANISMES ET DE THEMES DE RECHERCHE DONT L'ACTION DOIT ETRE CONFORTEE
A. LES THEMATIQUES DECLINEES SONT REVELATRICES DE LA VIVACITE DE LA RECHERCHE FRANÇAISE
Elles portent notamment sur la connaissance des virus, sur leurs mutations, sur les caractéristiques générales des maladies infectieuses, sur les vaccins, les tests, les médicaments anti-viraux, mais aussi sur l'analyse des comportements sociaux face aux infections virales, face à la prévention et au traitement.
De multiples organismes participent à ces recherches. Il ne s'agit pas de tous les citer, mais de mettre en évidence l'action de quelques uns. Seront retenus l'INSERM, l'Institut Pasteur et l'INRA.
Une étude exhaustive mettrait en lumière l'importance de la recherche universitaire et le rôle du CNRS, dont les laboratoires sont souvent communs aux trois organismes précités.
Deux organismes mériteraient par ailleurs d'être entendus dans le cadre d'une recherche plus approfondie de l'action à envisager dans le Tiers Monde : l'IRD et le CIRAD, dont les études portent sur l'amélioration des outils de diagnostic et d'épidémiologie moléculaire, ainsi que sur le développement des vaccins et antiviraux.
B. IL FAUT CONTINUER DE SUSCITER, PROMOUVOIR ET FINANCER DE NOUVELLES RECHERCHES
Des connaissances limitées rendent nécessaires un effort de recherche plus important et plus diversifié :
- sur les modes de transmission du virus,
- sur sa virulence,
- sur la mortalité indirecte,
- sur l'évaluation des mesures de prévention (on n'a jamais vraiment testé l'efficacité des masques et les effets induits par un lavage plus régulier des mains),
- sur l'impact sanitaire, économique et collatéral de la fermeture des écoles,
- sur la manière de comptabiliser les décès,
- sur l'effet de la grippe dans les pays du Tiers Monde et sur les moyens qui devraient être mis à leur disposition (les infections respiratoires sont la première cause de mortalité en Afrique sub-saharienne),
- sur l'apport des modèles mathématiques et des scénarios pour prévoir l'impact d'une pandémie,
- sur les réactions de la population, sur la nature des rumeurs, sur l'attitude générale face à la vaccination, sur l'appréhension par les citoyens des risques comparatifs liés à la grippe et aux vaccins.
- sur la sérologie après la pandémie, pour évaluer les résistances acquises par les vaccinés, ainsi que la proportion de personnes qui n'ont eu ni vaccin ni grippe visible mais ont acquis des anticorps.
Ces thèmes ne sont pas limitatifs. Ils montrent l'ampleur du travail qui reste à accomplir.
Une réflexion doit par ailleurs être menée sur les financements à prévoir, et sur la manière de financer des recherches urgentes, notamment par l'A.N.R.
II. LES ACTIVITES DE L'INSERM
- L'INSERM est le seul organisme public de recherche français entièrement dédié à la santé humaine. Il s'est vu confier, en 2008, la responsabilité d'assurer la coordination stratégique, scientifique et opérationnelle de la recherche biomédicale.
Créé en 1964, l'Institut national de la santé et de la recherche médicale, établissement public à caractère scientifique et technologique, placé sous la double tutelle du ministère de la Santé et du ministère de la Recherche, a créé dix instituts thématiques qui lui sont associés afin d'exercer sa mission de coordination. Cette démarche renforce les partenariats qu'il a conclus dès l'origine avec les autres instituts de recherche publics et privés, l'Université et les hôpitaux 80 % des 318 unités de recherche Inserm sont implantées au sein des centres hospitalo-universitaires, ou des centres de lutte contre le cancer).
- Cette coordination est renforcée depuis avril 2009 par la création de l'Alliance nationale pour les sciences de la vie et de la santé , dont l'Inserm est signataire avec d'autres organismes et instituts de recherche et la conférence des présidents d'université. L'Alliance s'appuie elle-même sur 10 instituts thématiques multi-organismes, dont la direction est assurée conjointement par des organismes de recherche (Inserm, CNRS, CEA ou INRA (selon le domaine de recherche).
- Ce réseau a réagi rapidement lors de l'apparition du virus A(H1N1), en faisant se réunir, chaque mois, une quarantaine de scientifiques de toutes disciplines, spécialistes de la santé humaine et animale, et représentants des principales organisations de recherche françaises.
L'Institut thématique multi-organismes Microbiologie et maladies infectieuses (IMMI), et l'Institut thématique multi-organismes Santé publique ont fait des propositions d'animation, de programmation et de coordination des activités de recherches, en lien avec les ministères de la Santé et de la Recherche.
Trois groupes de travail H1N1 ont ainsi été constitués autour des thématiques suivantes :
- aspects cliniques, épidémiologiques et de sciences humaines et sociales,
- aspects de diagnostic,
- aspects plus fondamentaux et de vaccinologie.
Chacun de ces groupes, piloté par un comité de quatre personnes, a fait appel à une quinzaine de scientifiques, impliquant des laboratoires hospitaliers et le secteur privé afin d'identifier et de mettre en place des projets de recherche prioritaires.
- La priorité a été donnée dans un premier temps aux projets de cohorte, d'évaluation des tests diagnostiques, de risques de réassortiment du virus et de réponse immunitaire au vaccin.
Quatre cohortes ont ainsi été constituées :
- CoPanFlu , formée de 1000 ménages tirés au sort afin d'étudier les facteurs de risque d'infection, de préciser comment se transmet la grippe et comment s'exprime l'infection ; l'objectif recherché est de contribuer à la veille sanitaire grâce à une analyse en temps réel des données cliniques et virologiques ;
- FluCo , qui comprendra 1500 patients atteints de grippe A, dont 500 formes graves, afin de déterminer les facteurs de risque de formes graves et l'efficacité des traitements ; quelques essais seront menés pour évaluer l'efficacité des corticoïdes à faibles et fortes doses sur certaines surinfections ;
- CoFluPreg , qui mesurera l'incidence de la grippe pandémique et ses conséquences maternelles et périnatales chez 2000 femmes enceintes ;
- FluHop qui suivra la réponse immunitaire au vaccin saisonnier et pandémique chez 180 personnels hospitaliers.
- Des études sont également en cours en matière d'essais vaccinaux, d'essais thérapeutiques de recherche fondamentale et dans le domaine des sciences humaines et sociales.
D'autres projets sont en cours d'évaluation, notamment en recherche plus fondamentale (études génétiques du virus, développement d'autres inhibiteurs viraux, évolution virale en relation avec la réponse immunitaire, modélisation, physiopathologie et modèle animal de la pneumopathie virale).
III. LES ACTIVITÉS DE L'INSTITUT PASTEUR
L'Institut Pasteur est en première ligne, du fait de son positionnement de niveau mondial en matière de virologie et de vaccinologie. C'est lui qui a élaboré les tests du virus pandémique. C'est lui qui participe en tant que centre de référence au réseau GROG.
Plusieurs de ses structures travaillent en liaison permanente avec l'InVS. Il s'agit du Centre national de référence (CNR) pour la grippe Région-Nord à l'Institut Pasteur, de sa Cellule d'intervention biologique d'urgence (CIBU), de la plate-forme Génotypage des Pathogènes et Santé Publique, ainsi que de son unité Immunité anti-virale, biothérapie et vaccins.
De manière plus précise, l'Institut indique que :
« Le Centre national de référence (CNR) pour la grippe Région Nord à l'Institut Pasteur est habituellement chargé par le ministère de la Santé de centraliser la surveillance des cas de grippe concernant le nord de la France. Ce centre s'appuie sur les activités de recherche de l'unité de Génétique moléculaire des virus ARN. Dans le cadre de la situation exceptionnelle due à l'apparition du nouveau virus de la grippe A(H1N1), l'équipe spécialisée du CNR est mobilisée. Elle analyse tous les cas suspects de la région nord de la France et a mis au point un test rapide et fiable diffusé dans les laboratoires hospitaliers français de première intention faisant partie du réseau "grippe A" et dans les laboratoires du Réseau International des Instituts Pasteur (RIIP).
La Cellule d'intervention biologique d'urgence de l'Institut Pasteur (CIBU) , qui fonctionne 7j/7 et 24h/24, est également mobilisée. Créée fin 2002 à l'initiative de la Direction Générale de la Santé et de l'Institut Pasteur, elle est conçue pour réagir immédiatement en temps réel, en cas d'épidémie, pour détecter et identifier le plus rapidement possible le ou les agents pathogènes en cause. La CIBU vient en renfort pour analyser en étroite collaboration avec le CNR les suspicions de grippe A (H1 N1).
L'une des dix plates-formes de la Génopole de l'Institut Pasteur, la plate-forme Génotypage des Pathogènes et Santé Publique est elle aussi mobilisée, pour le séquençage des souches virales faisant partie du processus de diagnostic. La principale mission de cette plate-forme est de fournir un appui scientifique et technique aux laboratoires français de surveillance ou d'expertise microbiologique dans les domaines des maladies infectieuses, et notamment dans l'aide à l'identification moléculaire et au typage moléculaire des agents pathogènes en cause, et ceci particulièrement en cas d'urgence microbiologique mettant en péril la santé publique au niveau national.
Enfin, l' unité Immunité anti-virale, biothérapie et vaccins est impliquée dans une vaste étude internationale visant à retracer l'histoire naturelle de l'infection par le nouveau virus dans le monde. Cette unité est aussi impliquée, en collaboration avec le CIC Cochin-Pasteur, dans plusieurs études cliniques visant à évaluer la réponse immunitaire au virus et au vaccin pandémique dirigé contre ce nouveau virus A(H1N1) chez des femmes enceintes, des patients immunodéprimés et des personnes séropositives ».
Le rôle de l'Institut ne s'arrête pas là puisque c'est le virologiste responsable de la CIBU qui préside le Comité de Lutte contre la grippe, créé par le décret n°2008-733 du 25 juillet 2008, et qui est chargé d'apporter au ministre de la santé une expertise sur l'ensemble des mesures à mettre en oeuvre pour contrôler et réduire l'impact d'une épidémie de grippe ou d'une pandémie grippale.
IV. LES ACTIVITÉS DE L'INRA
L'INRA est concerné, lui aussi, de manière très importante par le virus A(H1N1), car ce virus combine des éléments de nature animale et humaine.
L'Institut national de recherche agronomique présente ainsi ses recherches :
« L'Inra développe des recherches pour mieux connaître l'évolution des génomes et des structures des protéines des virus responsables des grippes animales ou influenza, comprendre les mécanismes de la relation entre virus et cellule animale, mettre au point des stratégies vaccinales et étudier l'épidémiologie de ces grippes.
Les virus influenza ont généralement une grande spécificité d'espèce, c'est-à-dire qu'ils infectent une espèce donnée (hommes, porcs,oiseaux, chevaux, phoques).Mais, lors de transmissions multiples ponctuelles dans un hôte commun (canard, porc), les différents virus peuvent échanger du matériel génétique, ce qui leur permet de s'adapter à une nouvelle espèce. C'est ce qui est sans doute arrivé dans l'émergence du H1N1 (2009). Et c'est ce que l'on craint pour un virus hautement pathogène comme le H5N1. Présent actuellement dans les populations d'oiseaux de plus de 60 pays, il pourrait acquérir par réarrangement génétique la capacité de se transmettre d'homme à homme. Une recombinaison entre le H5N1 et le H1N1 serait particulièrement redoutable.
Depuis quelques années, l'Inra et ses partenaires ont intensifié les recherches sur l'influenza aviaire. Nous nous impliquons aussi bien dans l'étude des souches virales que dans l'étude des interactions hôte-pathogène. Nous progressons aussi bien dans le domaine des connaissances fondamentales que de leurs applications. Ainsi, nos équipes utilisent la génétique inverse pour obtenir en laboratoire des combinaisons virales afin de tester et comparer leur virulence, ou d'introduire des mutations ciblées pour identifier les gènes impliqués dans la virulence. La génomique des espèces cibles (porc, volaille) nous permet d'identifier les gènes « candidats » qui sont à rechercher au niveau des points de contact entre le virus et la cellule-hôte, interactions déterminantes dans l'acquisition de la spécificité d'espèce. L'Inra dispose en outre d'une structure d'expérimentation animale confinée de niveau 3, à Tours, ayant vocation européenne. Un « bureau des grippes » coordonne les collaborations avec l'institut Pasteur, le Cirad, l'Afssa et le CNRS. »
Tandis que l'épidémie de grippe A continue de sévir dans le monde, des équipes de l'INRA et du CEA publient des travaux de recherche qui expliquent comment le virus responsable de cette pathologie peut leurrer le système immunitaire de ses victimes. Le mécanisme découvert pourrait expliquer pourquoi les femmes enceintes , qui expriment des quantités très fortes de molécules HLA-G, sont plus vulnérables à l'épidémie actuelle .
Le communiqué publié par l'INRA est particulièrement intéressant :
« Les chercheurs ont montré que l'entrée de ce virus dans l'organisme provoque l'expression d'une protéine appelée HLA-G, qui est connue pour inhiber le système immunitaire. En induisant de manière anormale cette protéine, le virus empêcherait les cellules immunitaires de se débarrasser de lui. Ce mécanisme pourrait expliquer pourquoi les femmes enceintes, qui expriment des quantités très fortes de molécules HLA-G, sont plus vulnérables à l'épidémie actuelle. Ces résultats sont publiés en ligne sur le site de la revue « Human Immunology». Des études complémentaires sont en cours pour comprendre le mécanisme par lequel le virus de la grippe A augmente l'expression de la protéine HLA-G. »
Des chercheurs de l'INRA et de l'INSERM étudient actuellement par ailleurs le rôle protecteur qu'une protéine membranaire, appelée PAR2, pourrait jouer lors d'une infection par un virus H1N1 .
Ils expliquent ainsi ce phénomène, qui a fait l'objet de publication dans « The Journal of Immunology » du 15 juin 2009 : « L'activation de ce récepteur PAR2, maillon important du système immunitaire, induit chez la souris une production accrue de cytokines qui neutralisent le virus en bloquant sa réplication. Des études complémentaires sont nécessaires pour vérifier l'efficacité de ce rôle protecteur contre les multiples souches du virus de la grippe » .
SCHEMA DE REPRODUCTION DU VIRUS DE LA GRIPPE
DANS LA CELLULE HÔTE
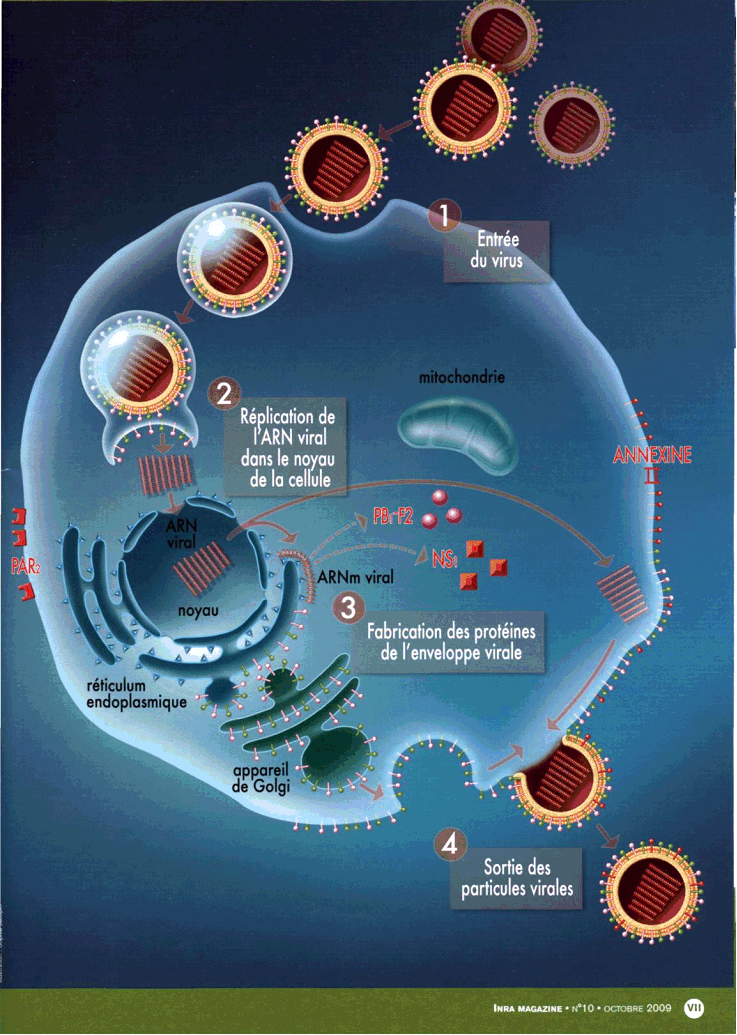
SIXIEME PARTIE: LA SITUATION AUX ETATS-UNIS
Observer la situation aux Etats-Unis est particulièrement intéressant : le contexte y est différent, tant en ce qui concerne l'organisation administrative de la politique sanitaire qu'en ce qui concerne l'évolution de la grippe. L'action publique sur la grippe s'est déroulée en même temps que le débat sur la pertinence d'une couverture sociale de santé.
I. LA RÉPARTITION DES COMPÉTENCES ENTRE LA FÉDÉRATION ET LES ETATS FÉDÉRÉS OBLIGE LES ORGANES FÉDÉRAUX DES ETATS-UNIS À FAIRE PREUVE DE CONVICTION ET DE PERSUASION
A - LE ROLE DE L'ETAT FEDERAL EST PAR DEFINITION LIMITE
Sous l'autorité du Président des Etats-Unis, qui peut affecter certains fonds alloués par le Congrès, le ministère fédéral de la santé n'a pas une compétence aussi grande que son homologue français. Les Etats fédérés et à un moindre niveau les comtés sont en effet les organismes compétents en matière de santé publique. L'Etat fédéral intervient quand un problème dépasse le niveau de l'Etat, ce qui est le cas d'une pandémie.
L'Etat fédéral apporte des financements, a un rôle régulateur, répartit les stocks de produits médicaux entre les Etats, décide de leur gratuité éventuelle. Les Etats fédérés tiennent à leur pouvoir et les directives des organes fédéraux ne s'appliquent que si les Etats fédérés y adhèrent.
C'est dans ce contexte qu'il faut replacer les déclarations du Président des Etats-Unis. Sa décision du 24 octobre 2009 de déclarer l'état national d'urgence sanitaire n'a pas la même portée symbolique qu'elle aurait eu en France. C'est principalement une mesure d'ordre administratif, de portée réglementaire et financière qui a permis aux hôpitaux américains de renforcer la capacité et l'organisation de leurs services d'accueil et d'urgence pour mieux faire face à une surcharge temporaire éventuelle de patients.
B - LES DECLARATIONS DU PRESIDENT DES ETATS-UNIS ONT ESSENTIELLEMENT UN EFFET MEDIATIQUE OU PUREMENT ADMINISTRATIF.
Deux dates méritent d'être relevées : le 26 avril 2009 et le 24 octobre 2009.
1. Le 26 avril 2009 : le Président fait une première déclaration
Cette déclaration intervient après la confirmation de vingt cas non mortels dans le pays, et l'annonce que la maladie devrait s'étendre.
Le Président Obama fait savoir par M. John Brennan, son conseiller à la Sécurité intérieure, qu'il surveille de près l'évolution du virus et qu'il a ordonné une "réponse efficace, énergique, coordonnée".
Mme Janet Napolitano, ministre de la Sécurité intérieure, souligne que cette procédure est habituelle. Elle a pour objectif de libérer des personnels et des fonds pour concentrer l'effort sur la prévention du virus. Elle va de pair avec un dépistage des personnes qui se présenteraient aux frontières en provenance de pays touchés par le virus et qui pourraient isolés en vertu des règles en vigueur.
2. Le 25 octobre 2009 : le Président proclame l'état d'urgence sanitaire aux Etats-Unis
Cette proclamation du Président Barack Obama intervient à un moment où la grippe H1N1 a entraîné, depuis le printemps, plus de 1.000 morts aux Etats-Unis (contre plus de 5000 à l'échelle mondiale). 46 Etats sont atteints, et les cas signalés concernent des millions de personnes, alors que les vaccins ne sont pas aussi disponibles que prévu. Ce même jour, 16,1 millions de doses de vaccin étaient prêtes à être livrées. Ce nombre devait atteindre fin octobre 30 millions au lieu des 40 millions prévus initialement, selon les CDC (en juillet, les autorités avaient envisagé que 120 millions de doses seraient disponibles en octobre).
Pour le Président des Etats-Unis, "la rapide augmentation des cas à travers le pays risque de submerger les services de santé. En identifiant rapidement le virus, en mettant en oeuvre des mesures de santé publique, en informant les professionnels de santé et le public et en mettant au point une vaccination efficace, nous avons pris des mesures énergiques pour réduire l'impact de la pandémie et protéger la santé de nos citoyens".
La déclaration, qui qualifie la situation "d'urgence nationale" renforce les capacités des centres médicaux à gérer l'afflux de patients atteints par le virus, en leur permettant de mettre en place des opérations d'urgence sans se conformer à certaines exigences administratives fédérales.
Cette mesure permet également de permettre aux personnes qui relèvent des programmes Medicare (les plus de 65 ans) et Medicaid (patients à faibles revenus) de pouvoir être vaccinées sans condition.
La Maison Blanche la présente comme « pro-active », et comme une décision semblable à une déclaration d'état de catastrophe comme en cas d'ouragan.
C - L'ETAT FEDERAL S'APPUIE NEANMOINS SUR UN RESEAU D'INSTITUTIONS EXTREMEMENT PUISSANT
Le ministère de la santé ( National Health and Human Services - NHH) coordonne l'activité de plusieurs institutions :
La FDA ( Food and Drug Administration ) donne notamment les autorisations de mise sur le marché.
La BARDA ( Biomedical Advanced Research Development Authority ) dont le rôle est largement semblable à celui de l'EPRUS est chargée de gérer les stocks de médicaments, de masques et d'antiviraux. La BARDA gère également les commandes, suit les contrats, leurs options d'annulation et les pénalités éventuelles qui y sont liées.
Les CDC ( Centers for Disease Control ) ont un rôle de surveillance, de veille et de recherche. Ils remplissent les fonctions de l'InVS mais aussi de laboratoires tels que l'Institut Pasteur. Sur leurs 11000 employés, environ 2000 suivent la grippe.
Les NIH ( National Institutes of Health ), organismes puissants dans le domaine de la recherche sur la santé, regroupent 27 instituts.
D - L'ORGANISATION DE LA CHAINE DE COMMANDEMENT EST ESSENTIELLE
Cet ensemble est particulièrement structuré et coordonné.
- Le ministre de la Santé est, sous l'autorité du Président, le pilote de l'action fédérale. Son action est encadrée par plusieurs textes fondamentaux :
- la loi de juillet 2004 sur un projet de bouclier biologique ( Project Bioshield Act )
- la Stratégie Nationale pour la grippe pandémique de novembre 2005 ( National Strategy for Pandemic Influenza)
- la loi de décembre 2005 dite loi PREP, sur la préparation des situations d'urgence ( The Public Readiness and Emergency Preparedness Act )
- la loi sur la préparation à la pandémie et aux situations à risque ( The Pandemic and All-Hazards Preparedness Act ) de décembre 2006, qui crée la BARDA.
- Son intervention en cas de situation exceptionnelle reflète bien l'enchaînement des responsabilités.
En cas d'urgence, le ministre de la santé ( Secretary of DHHS ) peut autoriser l'utilisation de certains produits médicaux.
Cette responsabilité est déléguée au commissaire de la FDA qui peut autoriser l'utilisation d'un produit non approuvé, ou l'utilisation non approuvée d'un produit approuvé, sur la base de certains critères.
Avant l'intervention de la FDA, le ministre doit faire une déclaration sur l'urgence de la situation. La FDA prend alors des décisions au cas par cas et spécifie la durée de ces mesures.
Les institutions qui relèvent de l'autorité du ministre de la santé ont une organisation interne qui permet une coordination de l'action de l'Etat. Leur organigramme fait apparaître clairement la chaîne de commandement.
SCHÉMA DE LA COORDINATION NATIONALE DE LA
LUTTE
CONTRE LE VIRUS A(H1N1) AUX ETATS-UNIS
- L'exemple des CDC est particulièrement intéressant.
1701 employés chargés de la grippe H1N1 de 2009 y relèvent de l'autorité du responsable des incidents. Ce responsable est assisté de trois personnes (un adjoint, un responsable du personnel, un responsable sanitaire), et dirige une équipe de commandement de 655 personnes ainsi que six équipes composées respectivement de 388 personnes travaillant en laboratoire, 97 personnes chargées d'atténuer les incidents locaux, 114 personnes chargées des soins et des contre-mesures médicales, 196 spécialistes des vaccins, 64 personnes faisant la coordination avec les Etats fédérés et 187 personnes s'occupant des media. Les 655 employés de l'équipe de commandement sont chargés plus particulièrement de la logistique, de l'appréhension de la situation, de l'élaboration de plans et de politiques, d'opérations concrètes, de questions administratives et financières et de relations avec l'extérieur.
- L'organigramme de la Food and Drug Administration est lui aussi riche en enseignements, tant il couvre de domaines.
TASK FORCE DE LA FOOD AND DRUG ADMINISTRATION
E - LES ORGANES FEDERAUX DOIVENT CONVAINCRE LES ETATS ET LES COMTES DE LA PERTINENCE DE LEURS RECOMMANDATIONS ET DE LEURS ACTIONS.
L'avis des gouverneurs est essentiel pour qu'une action fédérale soit organisée sur le territoire de l'Etat dont ils sont les élus.
Les comtés décident des mesures pratiques à mettre en oeuvre. Ils n'appliquent les recommandations fédérales en matière de santé publique que s'ils sont convaincus de leur bien-fondé.
Les institutions fédérales ont une conscience aigue de ce rapport de forces. Elles savent que leur efficacité dépend de leur capacité de persuasion. Leur rôle est essentiellement consultatif. Elles considèrent qu'elles doivent principalement proposer des directives et fournir des informations tout en faisant preuve de pédagogie. Elles peuvent être amenées à rappeler aux Etats le contenu de leurs directives. Elles sont intervenues lors de la pénurie de vaccins pour demander aux Etats d'en tenir compte dans leurs décisions.
Mi janvier, la situation est encore très différente selon les Etats et les comtés. Les règles applicables à la vaccination diffèrent souvent, mais seuls deux Etats ne proposent pas la vaccination à l'ensemble de la population. Les différences portent essentiellement sur le rôle des pharmaciens dans la vaccination, sur les dispositions relatives à l'âge des différentes catégories de patients à vacciner en priorité, et sur l'obligation de prouver son appartenance à l'une des catégories à risque.
II - LA COMMUNICATION EST UN ÉLÉMENT FONDAMENTAL DE L'EFFICACITÉ DE CE SYSTÈME
A - ELLE EST EXTREMEMENT ACTIVE ET ORIGINALE
- Elle repose sur l'anticipation des réactions des citoyens. Elle tient compte des réactions des leaders d'opinion sceptiques.
L'objectif des responsables de la communication est d'arriver à anticiper les critiques et de trouver les moyens d'y répondre.
Les méthodes utilisées lors de la campagne présidentielle sont largement reprises. Des messages sont ainsi diffusés via Facebook et Twitter .
Cette communication est ciblée vis-à-vis de diverses catégories de la population : jeunes, personnes âgées, minorités, groupes à risque. Une attention particulière est accordée aux associations, laïques ou religieuses, et aux organismes communautaires.
Des spots télévisés destinés aux jeunes sont réalisés en se basant sur les séries télévisées.
- Une expérience originale mérite d'être mentionnée : un débat d'une journée à huis clos a été organisé entre autorités en charge de la santé publique, experts et représentants des media. Les discussions portaient sur ce qui se passerait en cas de difficultés inattendues. Un jeu de rôle amenait chacun à expliquer ce que seraient ses réactions. Cela a permis de mieux comprendre les attitudes et les attentes des divers partenaires confrontés à des situations défavorables.
B - ELLE EST DOTEE DE MOYENS IMPORTANTS
Des moyens imposants y sont consacrés. Soixante personnes en sont chargées aux CDC, ce qui permet à la cellule communication de connaître la nature des messages qui circulent sur Internet, et de préparer des messages qui seront diffusés. Les six responsables de la définition de ses orientations stratégiques s'appuient sur des équipes de gestion de l'information qui suivent les media et font l'inventaire de toutes les informations disséminées, notamment dans les blogs et les forums de discussion.
Des employés sont chargés de répondre aux appels téléphoniques de la population. Des programmes sont diffusés à la radio. Les rapports consacrés à la grippe et les articles des media sont systématiquement analysés, en utilisant notamment les outils que constitutent Argus, ProMed et HealthMap.
Une surveillance journalière d'Internet est organisée, afin d'analyser les questions abordées et d'anticiper les réponses à y apporter. Six personnes sont plus particulièrement chargées d'observer les sites les plus fréquentés.
Cette communication a une double dimension : nationale et internationale. Les capacités qui y sont consacrées au plan international ont été renforcées.
Un plan de communication a été spécialement élaboré pour faire face à cette situation de crise et à la nécessité de communiquer en urgence. Une Charte des communications d'urgence a été spécialement rédigée.
Tous les messages destinés au public doivent être validés. Des contacts réguliers avec les organisations de médecins, d'infirmières, de vétérinaires permettent de les préciser.
Une véritable réflexion est ainsi menée. Elle permet de décider de la nature des messages qui, face à des accusations infondées, ne mettent pas l'accent sur l'absence de complot, mais ont un contenu informatif sur le virus.
Du fait de la nature fédérale de l'Etat et des particularités du système scolaire, très émietté, cette communication doit être très décentralisée. Le CDC sont ainsi amenés à conseiller non seulement les Etats mais aussi les villes, les écoles, les universités, les entreprises et les services locaux de santé.
III - LA DYNAMIQUE DE LA PANDÉMIE N'A PAS ÉTÉ SEMBLABLE AUX ETATS-UNIS ET EN FRANCE, MAIS LE CONTEXTE DANS LEQUEL LES POUVOIRS PUBLICS ONT DU PRENDRE DES DÉCISIONS EST TRÈS PROCHE
A - LA PANDÉMIE A ETE BEAUCOUP PLUS PRÉCOCE, ET S'EST DÉJÀ DÉVELOPPÉE EN DEUX VAGUES
Les Etats-Unis ont été, avec le Mexique, l'un des premiers foyers majeurs de la grippe. Leur situation a été décalée par rapport à l'Europe.
La pandémie s'est développée plus tôt et plus rapidement aux Etats-Unis qu'en Europe. Elle s'accélère depuis l'automne. Selon l'OMS, les Etats-Unis sont le pays le plus touché au monde, loin devant le Mexique. Le nombre de cas de grippe est inhabituel si l'on compare la situation présente avec celle des années antérieures.
La première vague démarre fin avril 2009 et connaît un pic fin juin. La deuxième vague démarre après la rentrée scolaire et atteint un pic fin octobre. A titre de comparaison, la France n'a été touchée que par une vague pandémique qui démarre à l'automne.
L'importance de la première vague, par le nombre de personnes touchées et celui des hospitalisations, a joué un rôle important dans la campagne de communication des autorités sanitaires sur les mesures de prévention et l'utilité de la vaccination. Elle a également causé la vague de mécontentements pour pénurie de vaccin.
Le virus est apparu dans un nombre de lieux plus important qu'en Europe.
Au moment du deuxième pic, le 25 Octobre, on dénombrait environ 20 000 cas d'hospitalisations et un millier de morts aux Etats-Unis (pour environ 5000 au niveau mondial). A titre de comparaison, la grippe saisonnière fait 36000 victimes chaque année aux Etats Unis.
Le 11 janvier, le nombre de personnes contaminées approchait 60 millions et le nombre de décès dépassait 10 000. Globalement, la grippe pandémique a affecté autant de personnes que la grippe saisonnière classique. Davantage de personnes ont dû être contaminées, comme en France, au vu des études récentes faites sur les femmes enceintes.
Les CDC en ont conscience, les chiffres publiés étant présentés comme une estimation intermédiaire entre le bas et le haut d'une fourchette.
Le nombre de personnes vaccinées est approximativement le même que celui des personnes malades recensées par les statistiques. Il était de 46 millions mi-décembre, et de 60 millions environ mi-janvier.
A population égale, plus de personnes ont été vaccinées qu'en France (20 % de la population, contre 8%), mais plus de personnes ont aussi été infectées ou sont décédées de la grippe.
Aux Etats-Unis comme en France, on note les mêmes réticences de la population par rapport à la vaccination. Ces réticences ont probablement été aggravées par le retard pris dans la livraison des vaccins.
B - LE PRECEDENT DE LA GRIPPE AVIAIRE A JOUE UN ROLE CONSIDERABLE DANS LE PROCESSUS DECISIONNEL
Tant en France qu'aux Etats-Unis, les plans pandémie grippale ont été mis en place à la suite de la grippe aviaire.
Le virus H5N1 a créé le même choc dans les deux pays, du fait de sa dangerosité extrême (plus de 50 % des personnes infectées en mourraient). C'est du reste ce choc qui avait conduit l'Etat à accorder une immunité aux entreprises pharmaceutiques en matière de responsabilité civile par une loi de 2005 - la PREP - afin de les convaincre de fabriquer des produits permettant de s'opposer au virus (les entreprises restent cependant responsables en cas de faute grave).
Les mêmes questions se sont posées : comment prévenir sa diffusion ? Comment éviter la désorganisation de l'économie qui en résulterait ? Quelles mesures exceptionnelles envisager ?
Le plan américain et le plan français sont semblables dans leurs objectifs. Ils ont inspiré les mesures prises lors de la grippe A(H1N1) en avril et en mai 2009, lorsque l'on a craint - de la même manière - que le virus pandémique soit extrêmement dangereux.
L'incertitude étant renforcée par les déclarations de l'OMS, qui élève le 11 juin le niveau de pandémie (en passant de 5 à 6), les décisions gouvernementales reflètent dans les deux pays les réflexions antérieures sur la grippe aviaire.
Les autorités sanitaires relèvent que leur niveau de préparation et de réactivité n'aurait pas été le même sans la grippe aviaire et le plan pandémie.
Les autorités ont également tenu compte de l'expérience passée, et notamment des réactions insuffisantes des pouvoirs publics lors du cyclone Katrina (dont les effets médiatiques sont proches de ceux dûs en France à la canicule).
C - LES DECISIONS FONDAMENTALES DES POUVOIRS PUBLICS ONT ETE PRISES DANS LE MEME CLIMAT D'INCERTITUDE QU'EN FRANCE.
L'incertitude est la même. Les Etats-Unis ont néanmoins été confrontés plus tôt que la France à la pandémie, ce qui explique des réactions différentes en matière de commandes de vaccins (antigène en vrac pour les Etats Unis, en doses pour la France). La France a en effet pris des décisions postérieures à celles des Etats-Unis, en ayant une vision différente des choix possibles.
Au moment des commandes de vaccin, les scientifiques des deux pays estiment qu'il faudra deux doses de vaccin et qu'une grande partie de la population risque d'être atteinte. Le même choix est fait de rendre le vaccin disponible à tous ceux qui souhaiteraient se faire vacciner, tout en tenant compte des réticences d'une partie de la population.
C'est ainsi que les Etats Unis décident de commander plus de 250 millions de doses de vaccin.
À l'époque, les deux pays s'interrogent sur la manière de faire face à la pénurie de badiane (l'anis étoilé produit en Chine), produit nécessaire à la fabrication du seul antiviral efficace, le Tamiflu.
Face à cette incertitude, les deux pays veulent se prémunir contre une recombinaison des virus H1N1 et H5N1 qui pourrait entraîner l'émergence d'un virus à la fois dangereux et très contagieux. Ils font la même analyse des capacités d'évolution du virus, et de l'utilité de la vaccination, qui reste le seul moyen d'endiguer une propagation exponentielle du virus.
D - IL EST INDISPENSABLE D'ETABLIR L'HISTORIQUE DES DECISIONS ET DE LES REPLACER DANS LEUR CONTEXTE TEMPOREL POUR EVALUER LEUR PERTINENCE
A quel moment a-t-on craint un virus très dangereux ? Comment s'en est-on protégé ? Quand s'est-on aperçu que le virus était moins agressif que prévu ? A quel moment a-t-on estimé qu'une seule dose de vaccin serait nécessaire ? Telles sont les questions auxquelles il faut apporter des réponses aussi précises que possible.
Dès le 15 avril 2009, les Etats-Unis se rendent compte de l'existence d'une nouvelle forme d'H1N1. Le 21, les CDC communiquent sur deux cas de cette grippe aux Etats-Unis. Le 24, l'OMS déclare l'apparition d'une pandémie . Le 27, elle recommande les souches virales qui ont donc été rapidement identifiées, la coopération entre l'OMS et ses laboratoires de référence ayant bien fonctionné.
Le 28 avril, les CDC envoient les souches vaccinales dans plusieurs pays et à plusieurs laboratoires pour étudier la faisabilité de vaccins appropriés. Seule l'Indonésie réclame de bénéficier des droits de propriété intellectuelle sur les souches découvertes sur son territoire.
Les Etats-Unis s'adressent alors aux producteurs de vaccins saisonniers avec lesquels ils travaillent habituellement, en grande partie pour ne pas avoir à recourir à de nouvelles et longues procédures d'autorisation de mise sur le marché (AMM).
Ils considèrent qu'il est fondamental de faire appel à plusieurs laboratoires, choix qui s'est révélé judicieux du fait des difficultés rencontrées par certains d'entre eux.
Le choix est par ailleurs fait de ne pas prévoir de nouvelles autorisations, étant donné les connaissances disponibles sur le virus H1N1. Il est de même décidé de ne pas recourir à des procédures d'autorisation d'urgence.
Cinq entreprises sont choisies : Medimmune, Sanofi Pasteur, Novartis, GSK et CSL. Novartis et Sanofi fourniront le plus de vaccins, GSK moins car elle a privilégié le Canada, tandis que CSL ne fournira pas toutes les doses prévues du fait des besoins du marché australien. Baxter n'en fait pas partie, car elle n'a pas de licence pour le vaccin saisonnier aux Etats-Unis qui travaillent néanmoins avec cette société sur la culture cellulaire.
Les essais cliniques ont lieu en août. 5 000 personnes sont testées, non pour vérifier la sécurité des vaccins, mais pour déterminer le dosage souhaitable pour les femmes enceintes. Leurs résultats sont connus fin septembre début octobre, ce qui permet à la FDA d'approuver les vaccins qui lui sont présentés.
Des essais cliniques d'un vaccin pédiatrique inactivé non adjuvé sont par ailleurs réalisés par Sanofi-Pasteur, après accord de la FDA. Ces essais ont pour objet d'une part de déterminer la concentration d'antigène vaccinal optimale pour immuniser la population pédiatrique, d'autre part d'étudier la réponse immunitaire à l'administration simultanée ou successive des vaccins grippaux pandémique et saisonnier.
Les chercheurs trouvent assez rapidement que la dose standard pour la majeure partie de la population devait être de 15 microgrammes, et non de 30.
Il apparaît très vite que le A(H1N1) est moins dangereux que prévu, mais que sa dangerosité est sélective et différente de celle du vaccin saisonnier : ses conséquences peuvent être graves pour des populations qui ne sont pas généralement particulièrement affectées lors des grippes saisonnières. Les jeunes sont plus atteints, alors même qu'ils ne présentent pas d'antécédents les rendant plus fragiles aux maladies respiratoires aigues.
Ce n'est qu'en septembre que les scientifiques savent qu'une seule dose de vaccin sera nécessaire (ils le présagent au début du mois, et en sont certains à la fin de même mois). Le choix de deux doses pour les enfants est conservé, même si aujourd'hui il est remis en cause par les Australiens.
Ce choix d'une dose, fait par la FDA, a résulté de considérations scientifiques, et a donné lieu à de multiples échanges entre la FDA, les CDC et les NIH.
Depuis lors, des études sont régulièrement faites sur la sécurité des vaccins et la résistance aux antiviraux. Leurs résultats sont considérés comme très encourageants. Des travaux sont également menés sur des furets pour vérifier si le virus mute. Il apparaît que les recombinaisons restent très compliquées, même si l'on ne peut pas les exclure.
E - LES FINANCEMENTS MIS EN OEUVRE AU NIVEAU NATIONAL SONT PRESQUE SEMBLABLES QUAND ON LES RAPPORTE A L'IMPORTANCE RELATIVE DES DEUX POPULATIONS
Une lettre du Président des Etats-Unis à la Présidente de la Chambre des Représentants en date du 2 septembre 2009 en précise les montants :
Le Président rappelle que le Congrès a attribué 7,65 milliards de dollars au ministère de la santé au titre de la lutte contre la grippe H1N1 de 2009, dont 5,8 milliards de dollars affectés spécialement à la grippe pandémique. L'objectif poursuivi était de permettre le développement des vaccins adaptés au H1N1 de 2009, de financer leurs commandes, de poursuivre des activités de surveillance aux plans national et international, et de préparer la campagne d'immunisation de l'automne.
Le Président rappelle également que le 16 juillet, il a affecté 1,825 milliards de dollars de la somme réservée au virus pandémique pour répondre à des besoins particuliers liés à l'émergence des virus de la grippe. Il indique qu'en date du 2 septembre, il affecte sur cette somme réservée 2,716 milliards de dollars aux ministères de l'agriculture, de la défense, de la santé et des anciens combattants pour financer les achats de vaccins, de médicaments antiviraux et pour préparer la campagne de vaccination ainsi que pour subventionner les agences chargés de la mise en place de cette politique.
Au moins 350 millions de dollars sont affectés aux Etats et aux pouvoirs locaux pour renforcer leurs capacités d'action. Au moins 200 millions de dollars sont attribués aux CDC pour leurs activités de surveillance, leur recherche, leurs diagnostics, leur communication sur les risques, leur réponse rapide et les mesures de quarantaine.
La somme globale consacrée à la lutte contre le virus pandémique est plus importante. Elle semble difficile à établir, dans la mesure où il faut ajouter aux financements fédéraux les financements décidés par les Etats fédérés et les pouvoirs publics locaux. Aucune des nombreuses personnalités rencontrées par les rapporteurs n'a pu indiquer ce chiffre total.
À titre de comparaison, le Président Bush avait demandé en 2005 sept milliards de dollars au Congrès pour faire face au H5N1.
Le coût d'une dose de vaccin, mal et peu connu, est estimé entre cinq et dix dollars, somme à laquelle il faut rajouter des coûts de distribution et de vaccination considérés par tous comme importants.
F - UNE MISE A DISPOSITION DES VACCINS PLUS TARDIVE QUE PREVU
Il y a eu, comme en France, retard dans la livraison de vaccins par rapport au calendrier initialement établi.
Comme en France, il a fallu réserver le vaccin aux catégories prioritaires. C'est ainsi que la semaine du 6 au 12 décembre, 74 % du vaccin était utilisé par ces catégories, 42 % allant du reste aux enfants.
La pénurie ne s'étant estompée que quelques jours avant les fêtes de Noël, il en est résulté un sentiment de frustration. Le vaccin a enfin été produit en quantité suffisante après le pic de la pandémie.
Il y a aujourd'hui un excédent de l'offre de vaccins par rapport à la demande. L'intérêt se porte maintenant davantage sur la prévention de la grippe saisonnière que sur celle de la grippe pandémique.
IV. PLUSIEURS CHOIX SEMBLABLES ONT ÉTÉ FAITS DANS LA GESTION DE LA MALADIE
A - LES DEUX PAYS ONT LA MEME APPROCHE DE L'INUTILITE DES TESTS A PARTIR D'UNE CERTAINE PERIODE ET DE LA NECESSITE D'EVALUER AUTREMENT L'ETENDUE DE LA GRIPPE
- Ils considèrent pareillement que lorsque la pandémie se développe véritablement, les tests n'ont plus d'intérêt et les modèles mathématiques suffisent. Les tests ne sont donc utiles qu'en début de grippe.
Ils constatent de la même manière que la qualité des tests est très diverses . Ils choisissent l'un et l'autre de réserver les plus fiables aux catégories à risque.
Les Etats-Unis, qui se sont fixés pour objectif de produire 5 millions de tests, constatent que les tests utilisés ne sont fiables qu'à 50 %.
- Il en résulte dans les deux pays une évaluation du nombre des personnes infectées faite à partir d'autres indicateurs, notamment des déclarations des médecins.
Une étude récente 1 ( * ) faite en France suggère que le nombre des personnes touchées par le virus est beaucoup plus important (4 à 5 fois plus que ce que l'on pensait). Cette étude faite à partir d'analyses sérologiques relève que beaucoup plus de malades n'ont été atteints que de manière bénigne. Les Américains estiment que les mêmes résultats pourraient être trouvés aux Etats-Unis et considèrent que le nombre de personnes infectées est probablement le double de ce que reflètent les statistiques.
B - LES DEUX PAYS N'ONT PAS FAVORISE L'UTILISATION DU TAMIFLU A TITRE PREVENTIF
Le Tamiflu est un médicament récent aux Etats-Unis, qui, comme en France, reste d'un usage particulier. Il n'est du reste efficace que lors des premières 48 heures après l'apparition de l'infection. Mais il est actuellement le seul médicament véritablement utilisé en cas de grippe, le Relenza étant d'utilisation trop complexe. L'amantadine et la rimantadine sont quant à elles résistantes aux différents virus de la grippe et ne sont pas utilisés de manière habituelle.
Le Tamiflu a été réservé aux Etats-Unis aux soins curatifs pour les catégories à risque. On ne l'utilise généralement pas pour les personnes n'étant pas susceptibles d'avoir des complications.
Il est traditionnellement utilisé aux Etats-Unis chez les adultes, les adolescents et les enfants dès qu'ils ont plus de douze mois. Mais la FDA l'a autorisé pour la grippe pandémique pour les enfants de moins d'un an, dans le cadre d'une procédure d'autorisation d'urgence.
Un suivi particulier de ses effets est assuré par les CDC, en liaison avec la FDA, les organes locaux de santé publique, les professions médicales, les experts en antivirus et les comités consultatifs fédéraux. Leur objectif est de vérifier s'il est disponible en quantité suffisante, s'il est bien utilisé, si des cas de résistance apparaissent, s'il entraîne des effets négatifs et quel est son impact sur le système médical.
Ses effets secondaires sont étudiés dans le cadre de plusieurs programmes.
Les CDC précisent qu'il n'est pas adapté aux patients en bonne santé qui souffrent de grippe. Ils diffusent enfin une liste des personnes à qui le Tamiflu peut être recommandé : patients hospitalisés, patients souffrant de pneumonies, femmes enceintes, enfants de moins de deux ans, personnes souffrant de maladies chroniques, personnes âgées.
V LE CHOIX DES VACCINS A RÉPONDU À D'AUTRES CRITÈRES QU'EN FRANCE.
A - LE CHOIX FONDAMENTAL DE VACCINS SANS ADJUVANTS
C'est un choix constant aux Etats-Unis pour les vaccins contre la grippe saisonnière.
Les Etats-Unis n'ont jamais utilisé d'adjuvants dans les vaccins contre la grippe, qu'elle soit ou non saisonnière.
Il en découle qu'il est faux de faire, comme certains, un lien entre le choix de ne pas prendre d'adjuvant et l'expérience de la vaccination de 1976-1977 qui avait entraîné un débat sur le symptôme de Guillain Barré .
La littérature suggère par ailleurs que le nombre de Guillain Barré à l'époque était très proche du nombre moyen constaté aux Etats-Unis année après année.
Un comité de suivi, animé de façon indépendante par des citoyens est installé pour créer la confiance et faire l'inventaire des effets indésirables.
B - LES ETATS-UNIS N'ONT CEPENDANT PAS DE PREVENTION SANITAIRE A PRIORI CONTRE LES ADJUVANTS.
C'est essentiellement une question d'opportunité. Les décideurs sont convaincus qu'il est plus facile de convaincre la population de se faire vacciner si l'on ne change pas les modes traditionnels de production. S'il apparaissait par contre que les adjuvants sont nécessaires, soit pour faire face à une pénurie de produits vaccinaux, soit pour renforcer l'efficacité du vaccin, les autorités sanitaires n'excluent pas d'y recourir.
La FDA, comme les CDC, partagent cette approche essentiellement pragmatique, basée sur leur analyse de la perception des adjuvants par la population, qui les craint moins que la nouveauté.
Des stocks d'adjuvants de GSK et de Novartis ont été constitués, et les autorités sont prêtes à recourir à la procédure d'autorisation d'urgence en cas de besoin. Ces adjuvants sont également gardés en vrac, ce qui assure leur stabilité dans le temps.
C - LES ETATS-UNIS ONT EN FAIT CONTACTE LES PRODUCTEURS DE VACCIN AVEC QUI ILS TRAVAILLENT REGULIEREMENT LORS DE LA GRIPPE SAISONNIERE.
Plusieurs fabricants sont concernés : MedImmune, Novartis, Sanofi Pasteur, CSL, GSK.
- MedImmune , une division d' AstraZeneca qui l'a rachetée en 2007, produit FluMist, un vaccin particulièrement original.
- Novartis , qui commercialise en Europe un vaccin avec adjuvant sous le nom de Focetria, livre aux Etats-Unis un vaccin sans adjuvant, dénommé Fluvirin H1N1.
Ce vaccin est composé de cultures classiques à base de protéines d'oeuf. Une dose de 15 microgrammes est suffisante pour déclencher une réponse immunitaire efficace. Il n'est cependant pas compatible avec l'hypersensibilité aux protéines de l'oeuf.
- Sanofi Pasteur distribue aux Etats Unis un vaccin pandémique A(H1N1) homologué par la F.D.A. qui lui a délivré le 15 septembre l'autorisation de mise sur le marché.
Il résulte d'une modification de souche monovalente à partir du vaccin produit par le même groupe contre la grippe saisonnière. Il est indiqué dès l'âge de six mois.
Ce vaccin monovalent A(H1N1) dosé à 15 microgrammes, sans adjuvant, a fait l'objet d'essais cliniques aux Etats-Unis dès le 6 août pour déterminer ses effets après une dose. Les résultats montrent clairement qu'il est protecteur après une seule dose.
Ce vaccin ne doit toutefois pas être administré aux personnes présentant des antécédents d'hypersensibilité sévère aux protéines de l'oeuf.
Sanofi Pasteur avait reçu la première commande pour produire un vaccin de ce type dès le 25 mai, pour un montant de 190 millions de dollars de la part de l'US Department of Health ans Human Services (HHS) .
Cette commande rentrait dans le cadre des dispositions prises par le gouvernement américain pour stocker les vaccins pandémiques. Elle résultait aussi de l'expérience de Sanofi Pasteur qui a développé et homologué aux Etats Unis le premier vaccin prépandémique contre la grippe aviaire H5N1 et qui, dans son site américain de Swiftwater, aura prochainement une capacité de production de 150 millions de doses annuelles de vaccin contre la grippe saisonnière.
- CSL, entreprise australienne, propose le vaccin PanvaxH1N1
- GSK produit un vaccin qui sera finalement peu utilisé aux Etats-Unis.
D - LES PRODUITS SERVANT A FABRIQUER LES VACCINS ONT ÉTÉ STOCKES EN VRAC, CE QUI PERMET DE LES CONSERVER PLUS LONGTEMPS, OU DE PRÉVOIR LEUR RÉUTILISATION EN PLURIVALENTS, ET D'ÉVITER DE LES REVENDRE
Sur les 250 millions de doses de vaccin commandées (à partir de produits en vrac, permettant de faire 100 doses), 115 millions ont déjà été distribuées. Il est envisagé de poursuivre la distribution.
Les produits non utilisés seront considérés comme faisant partie du stock stratégique national géré par la BARDA. Les autorités n'envisagent donc pas pour l'instant d'annuler des commandes (ce qui ne signifie pas qu'il n'y aura pas de renégociation des contrats passés avec les laboratoires pharmaceutiques).
Le choix du vrac permet plus de souplesse et allonge la durée de conservation. L'inclusion dans les stocks des vaccins non utilisés permet de ne pas revendre les produits inutilisés. Ce choix donne également plus de flexibilité dans la gestion des contrats avec l'industrie pharmaceutique. Les marchés signés avec les laboratoires pharmaceutiques sont donc moins contraignants qu'en France.
E - UN VACCIN EN SPRAY CONNAIT UN SUCCES IMPORTANT
Ce vaccin, produit par Medimmune a été largement plébiscité. Il représentait 23 % des vaccins utilisés au 12 décembre 2009.
Une partie importante de la population a préféré ce mode d'administration du vaccin à l'injection.
Ce vaccin, qui n'est pas disponible en Europe, est produit à partir de virus vivants faiblement activés, ce qui entraîne parfois certaines craintes. Les autorités ont surveillé attentivement l'activation éventuelle du virus, et conclu que ce vaccin ne présente pas de danger particulier.
VI - DES MODES DE VACCINATION BEAUCOUP PLUS DIVERS
A - DES SOLUTIONS DIFFERENTES
C'est non seulement le résultat de l'histoire. C'est aussi la conséquence des structures et de la culture de la société américaine.
L'organisation de la vaccination découle tout d'abord du contexte particulier de compétences partagées ou complémentaires en matière de santé publique. Les Etats qui ont reçu les doses de vaccins s'organisent en fonction de la réalité de la pandémie qui touche sévèrement certains d'entre eux, mais en épargne relativement d'autres. Certains estiment qu'ils ne reçoivent pas assez de vaccins, d'autres trop.
La vaccination est organisée de manière beaucoup plus diverse qu'en France. Elle est organisée dans des centres de vaccination, comme en France, mais la présence de médecins n'y est pas prévue (les infirmières qui vaccinent peuvent appeler un médecin en cas de difficulté). Elle peut aussi se dérouler dans des supermarchés (les drugstores) ou en pharmacies. Seules les infirmières se déplacent, les médecins ne le faisant plus, sauf exception et à un prix extrêmement élevé.
En théorie, le vaccin est gratuit, mais en pratique les patients doivent supporter certains frais administratifs. La gratuité du vaccin a étonné la population, qui n'est pas habituée à ne pas payer ses médicaments (le vaccin saisonnier, qui n'est pas gratuit, coûte 200 dollars environ pour dix doses, hors vaccination).
Les drugstores proposent la vaccination contre la grippe pandémique à des prix proches de 20 dollars.
Les médecins libéraux n'ont pas été exclus de la vaccination mais ont, semble-t-il, peu vacciné eux-mêmes. Ils ont, d'après le médecin de l'ambassade de France, surtout orienté leurs patients vers le vaccin saisonnier.
B - DES CATEGORIES PRIORITAIRES TRES PROCHES AUX ETATS-UNIS ET EN FRANCE
Sont concernés comme prioritaires, tant que durera la situation de pénurie de vaccins :
- les femmes enceintes, les personnes à risques, les adultes atteints du VIH, de diabète, de maladies cardiovasculaires et d'asthme,
- les personnes qui s'occupent des enfants de six mois,
- les membres officiels des organismes locaux et nationaux de santé, des services sociaux, des cliniques, des laboratoires, des pharmacies,
- le personnel médical d'urgence, les services du personnel, les médecins,
- tous les jeunes de 6 mois à 24 ans,
- les adultes de 24 à 64 ans qui présentent des risques de complication.
Cette liste est assez proche de celle en vigueur en France.
C - UNE CAMPAGNE DE PROMOTION DE LA VACCINATION AUX MÊMES FINALITÉS QU'EN FRANCE
Cette campagne repose comme en France sur un effort très large de vaccination et sur la définition de groupes prioritaires. La vaccination est certes prévue dans les écoles, mais repose également sur la participation des acteurs sociaux (l'intervention envisagée des églises étant originale par rapport à notre pays).
Des vaccinations sont prévues dans les écoles et les universités avant, durant et après les heures de classes, ce qui implique d'organiser la collaboration entre les départements de Santé, les écoles privées et publiques. Les enfants ne seront vaccinés qu'avec l'accord préalable de leurs familles.
Les acteurs sociaux sont impliqués dans la planification de cette grippe afin d'obtenir la participation des organisations communautaires et confessionnelles. L'objectif recherché est de mobiliser toutes les forces vives pour garantir une information, un soutien et un suivi des personnes isolées et vulnérables. Les mesures envisagées sont décrites dans un rapport produit par le Center for Faith-Based and Neighborhood Partnerships au ministère américain de la Santé et des Services sociaux avec l'appui du CDC .
La communication relève du même esprit qu'en France, mais est dotée de moyens considérables.
Les CDC diffusent largement les plans de vaccination sur leur site Internet www.cdc.gov. C'est dans le cadre de ces plans qu'a été prévue une semaine nationale de la vaccination antigrippale du 6 au 12 Décembre 2009.
Un autre site Internet, diffuse également ces informations : www/flu.gov/individualfalily/vaccination/locator.html. Ce site du gouvernement américain est comparable au site français www.pandemie.gouv.fr .
Un comité de suivi animé de façon indépendante par des citoyens est installé pour créer la confiance et faire l'inventaire des effets indésirables.
D - LA CAMPAGNE EN FAVEUR DE LA VACCINATION EST RELANCEE LE 11 JANVIER 2010
La semaine du 11 janvier est en effet déclarée semaine nationale de la vaccination (il faut toutefois remarquer qu'une semaine de ce type est organisée chaque année depuis 2006 pour convaincre la population des bienfaits de la vaccination).
Les CDC estiment qu'au maximum 50 millions d'Américains pourraient encore se faire vacciner. Leur analyse découle de l'étude de deux courbes : celle du nombre de personnes ayant déclaré qu'elles se feraient vacciner en tout état de cause ; celle du nombre de personnes indiquant qu'elles se feraient peut-être vacciner.
La campagne menée actuellement tend à sensibiliser les associations religieuses, les travailleurs du service de santé, les américains d'origine indienne, africaine ou esquimau, les femmes enceintes, les jeunes et les personnes âgées. Elle s'organise autour de réunions et de messages diffusés sur des blogs.
VII. LA RECHERCHE DE NOUVEAUX VACCINS ET DE NOUVEAUX MÉDICAMENTS ANTIVIRAUX : ESPOIRS ET RÉALITÉS
A - L'ESPOIR D'UN VACCIN UNIVERSEL, PLURIVALENT, VALABLE PLUSIEURS ANNEES
Ce sont les qualités recherchées.
Des vaccins contre la grippe saisonnière qui sont trivalents existent déjà. Ils sont souvent peu différents de ceux en cours les années précédentes, car les virus saisonniers évoluent peu. Il n'est donc pas nécessaire de modifier fondamentalement ceux qui existent.
Le virus de la grippe pandémique A(H1N1) étant de nature différente, il a fallu trouver de nouveaux vaccins pour le contrer.
Des recherches sont néanmoins menées pour étendre le pouvoir de protection des vaccins actuellement disponibles.
L'espoir subsiste de trouver un vaccin efficace contre les différents types de grippe dont la durée de protection serait de quatre ou cinq ans.
B - LA CULTURE CELLULAIRE EST DE PLUS EN PLUS ETUDIEE EN COMPLEMENT DE LA CULTURE SUR OEUFS
Le stock d'oeufs disponible pour la production de vaccins est en effet limité. Ces oeufs doivent en outre avoir été conservés pendant onze jours dans des conditions particulières.
La réflexion a tout d'abord porté sur les conditions de production d'oeufs en quantité suffisante tout au long de l'année (traditionnellement les vaccins étaient produits de septembre à décembre sur des embryons d'oeufs), et 50 millions de dollars y ont été consacrés (la recherche fut confiée à Sanofi).
Parallèlement, la recherche s'est développée sur d'autres modes de culture, notamment cellulaires, et plus particulièrement sur des cellules de chenilles ou de primates. Quelques vaccins sont d'ores et déjà produits de cette manière. Plus chers, ils sont actuellement réservés aux personnes présentant des allergies à l'oeuf.
Cette recherche fait l'objet de financements importants, de l'ordre de deux milliards de dollars.
C - LA RECHERCHE DE NOUVEAUX VACCINS ET DE NOUVEAUX ANTI-VIRAUX
- La recherche sur les nouveaux vaccins porte sur des vaccins produits à partir de l'ADN, de la production de protéines ou de peptides de synthèse. Elle songe à utiliser des microbes comme vecteur, ou des particules semblables aux virus qui serviraient de leurre pour le système immunitaire.
- La recherche sur d'autres antiviraux que le Tamiflu ou le Relenza se porte sur des produits permettant de bloquer la liaison entre le virus et la cellule qu'il infecte, ou d'inhiber l'ARN.
Des recherches portent par ailleurs sur des zanamivirs et des oseltamivirs sous forme intraveineuse, tandis que le peramivir, également sous forme intraveineuse, fait actuellement l'objet d'une procédure d'autorisation.
D - LA MISE AU POINT DE TESTS PLUS RAPIDES, TOUT EN PRESERVANT LEUR FIABILITE
En règle générale, les tests vendus actuellement n'ont pas une efficacité suffisante pour assurer leur fiabilité. Seule la moitié d'entre eux seraient fiables.
Des recherches ont permis aux Etats Unis la production d'un test rapide appelé « chip test ».
La recherche se poursuit dans ce domaine, mais les chercheurs américains en trouvent les résultats décevants.
VIII - L'EXPÉRIENCE FRANÇAISE EST ÉTUDIÉE AVEC INTÉRÊT
Cet intérêt est dû essentiellement à trois raisons.
A - LES PRÉOCCUPATIONS DES MEDIA SONT DE PLUS EN PLUS SEMBLABLES, DU FAIT DE LA RAPIDITÉ DE TRANSMISSION DES INFORMATIONS
Les informations ne sont pas toujours semblables des deux côtés de l'Atlantique. Elles ne se diffusent pas forcément de manière instantanée, mais ont tendance, sur un problème commun, à circuler de plus en plus rapidement.
A titre d'exemple, les media ont interrogé les représentants de la FDA sur les commandes de vaccins et les vaccins qui ne seraient pas utilisés, quelques jours après l'annonce, en France, par la ministre de la Santé, de la renégociation des contrats avec les laboratoires et la vente à l'étranger des vaccins non utilisés.
B - L'EXISTENCE DE CHOIX DIFFÉRENTS DONNE PLUS DE LATITUDE A UN ETAT POUR DÉCIDER D'INFLEXIONS DE SA POLITIQUE SI LE CONTEXTE ÉVOLUAIT
Or le contexte peut évoluer. Tant en France qu'aux Etats-Unis, les virologues déclarent que par définition un virus peut évoluer et que les mutations virales sont constantes. Ces mutations n'ont pas toutes la même ampleur, mais l'on ne peut pas, pour l'instant, les prédire ou évaluer leur gravité potentielle.
Il est donc intéressant d'assurer une veille des solutions différentes adoptées dans les autres pays, surtout s'ils sont semblables en niveau de développement. L'existence de solutions alternatives peut être très utile en cas d'évènement inattendu. Il en serait ainsi s'il apparaissait une pénurie de vaccins, qui conduirait à s'interroger sur l'utilisation d'adjuvants.
C - DES COOPÉRATIONS INSTITUTIONNELLES EXISTENT ENTRE FRANÇAIS ET AMÉRICAINS
C'est le cas notamment de la coopération entre l'Institut Pasteur et les CDC d'Atlanta.
Cette coopération a été formalisée par un Memorandum of Understanding (M.O.U.) signé le 20 mai 2009. Ce texte prévoit notamment d'apporter un soutien à la mise en oeuvre du règlement sanitaire international, d'améliorer la coopération en matière de détection des menaces sanitaires et de formation, ainsi que de mener des actions conjointes dans des pays tiers.
Une coopération régulière existe également entre les organismes chargés de la surveillance sanitaire, qui échangent leurs données, en dehors même de ce qu'ils publient sur Internet. De tels échanges sont constants entre les CDC et l'InVS.
IX - LES FRANÇAIS AUX ETATS-UNIS ET LA VACCINATION
Deux cas doivent être distingués : les Français vivant de manière permanente aux Etats-Unis ; les touristes français.
A - MODALITÉS DE VACCINATION AUX ETATS-UNIS POUR LES RESSORTISSANTS FRANÇAIS
Les informations émanent de l'Ambassade de France et de ses consulats.
Voici les informations que l'on peut trouver sur le site du Consulat général de France à Chicago :
« Les ressortissants étrangers vivant aux Etats-Unis bénéficieront du même accès à cette vaccination que les citoyens américains.
Des vaccins spécifiques pour se protéger de l'infection contre le virus A/H1N1 sont actuellement en cours de fabrication. Le gouvernement américain a commandé 200 millions de doses de ces vaccins et prépare en liaison avec les Etats une vaste campagne de vaccination qui pourrait débuter fin octobre. Des populations prioritaires ont été identifiées en fonction du risque d'infection ou de la gravité de la maladie : femmes enceintes, entourage de jeunes nourrissons, adultes atteints de maladies chroniques et/ou de dépression immunitaire, enfants et adolescents (6 mois à 24 ans), professionnels de santé. Le vaccin sera distribué gratuitement dans des sites de vaccination collective ou dans des cabinets médicaux.
Les informations pratiques aux usagers relatives à cette campagne de vaccination seront prochainement disponibles sur les sites « internet » du Département de la Santé dans chaque Etat. Pour identifier l'adresse du site du Département de la Santé de votre Etat consulter www.cdc.gov/mmwr/international/relres.html ».
B - L'INFORMATION DISPONIBLE POUR LES TOURISTES FRANÇAIS
Fin octobre, le Consulat général commentait ainsi la situation :
« Depuis le 11 juin 2009, l'Organisation Mondiale de la Santé (OMS) a déclaré une situation de pandémie grippale (diffusion mondiale d'un nouveau virus de la grippe de type A/H1N1).
Aux États-Unis, la deuxième vague épidémique de grippe A/H1N1 qui a démarré début septembre s'est propagée dans 46 États à ce jour et poursuit sa progression. L'immense majorité des patients manifestent des symptômes grippaux modérés et guérissent en quelques jours. Le virus A/H1N1 touche plus fréquemment les enfants, les adolescents et les adultes jeunes. C'est la raison pour laquelle les rares cas graves et décès recensés depuis le début de l'épidémie se trouvent essentiellement dans cette population. Par ailleurs les femmes enceintes ont également une sensibilité particulière à ce virus.
La campagne de vaccination contre la grippe A/H1N1 préparée par le gouvernement américain et lancée mi-octobre rencontre certaines difficultés en raison de retards dans la fabrication industrielle des vaccins qui a engendré une pénurie momentanée. Cette situation devrait se corriger dans les prochaines semaines. A ce jour, 15 millions de doses de vaccins ont été distribués sur l'ensemble du territoire américain. Néanmoins dés à présent, et dans tous les Etats les personnes prioritaires pour recevoir la vaccination contre le virus A/H1N1 (femmes enceintes, jeunes enfants, professionnels de santé) peuvent trouver un centre de vaccination (dispensaire, école..) qui dispose de vaccins et organise des séances de vaccination (consulter le site du Département de la Santé de votre comté de résidence ou le site : www.flu.gov pour connaître les coordonnées de ces centres et les dates des séances de vaccination). En revanche très peu de cabinets médicaux disposent actuellement des vaccins.
Le 24 octobre, le Président Obama a déclaré l'épidémie de grippe A/H1N1 « Urgence Nationale ». Il s'agit d'une mesure administrative fédérale (de portée réglementaire et financière) qui permet aux Hôpitaux américains de renforcer la capacité et l'organisation de leurs services d'accueil et d'urgence pour mieux faire face à une éventuelle surcharge de patients. Cette mesure ne traduit donc pas une préoccupation nouvelle ni une aggravation brusque de la menace épidémique, mais s'inscrit dans la réponse « normale » à la progression éventuelle de l'épidémie au cours des prochaines semaines. Il n'y a donc pas lieu de modifier les recommandations en place auprès de la population en matière de préparation à cette épidémie. »
X. CONCLUSIONS PARTIELLES
Dans un pays fédéral où la compétence en matière de santé repose largement sur les Etats fédérés, les institutions fédérales n'ont véritablement d'influence que si elles parviennent à persuader les Etats et les collectivités locales -les comtés- de suivre leurs recommandations. Le succès de toute politique en dépend. D'autant plus que les solutions sanitaires sont dans de nombreux domaines d'ordre privé, portées par les assurances.
Les choix publics sont en conséquence expliqués de manière différente, de façon à emporter la conviction et l'adhésion.
Dans un pays où les media ont un rôle essentiel, la communication est particulièrement élaborée. Elle résulte d'équipes beaucoup plus nombreuses qu'en France, et d'une approche systématique d'anticipation des réactions de la population. Le message public est davantage travaillé, et passe par des canaux encore inutilisés en France, tels Facebook et Twitter.
Ne faudrait-il pas s'inspirer de cette méthode en France ? Ne faudrait-il pas par ailleurs, à l'image des Etats-Unis, mieux coordonner les structures françaises chargées de piloter la politique publique en cas de pandémie ? Ne faudrait-il pas, enfin, envisager des recherches davantage partagées, ce qui avait été le cas lors de la grippe aviaire ?
CONCLUSION GENERALE
La grippe A(H1N1) n'avait pas été prévue. Son déroulement a surpris les autorités sanitaires qui s'attendaient à une situation beaucoup plus grave. Elles redoutaient un virus aussi dangereux que celui de la grippe aviaire H5N1. La désaffection de la population pour la vaccination les a déconcerté.
Le pic pandémique est maintenant passé et certains peuvent avoir l'impression que la crise à laquelle notre société a échappé était finalement bénigne.
Les virologues sont cependant plus prudents. Ils réaffirment l'utilité de la vaccination. Ils savent qu'une pandémie peut se développer en plusieurs vagues. Ils craignent surtout qu'un virus mutant nouveau apparaisse, qui soit à la fois dangereux et très infectieux.
Les dispositions du plan pandémie avaient été conçues dans cet esprit. Elles demeurent valables pour faire face à cette hypothèse extrême. Elles apparaissent néanmoins trop rigides en situation intermédiaire.
C'est à cette situation intermédiaire, ou plutôt à ces situations intermédiaires qui risquent plus probablement d'arriver qu'il faut réfléchir.
Quelles mesures faudrait-il envisager face à un danger d'importance moyenne ? Quelle souplesse faudrait-il dans les marchés ? Qui faudrait-il faire participer à une réflexion qui permettrait de rendre davantage acceptable des mesures exceptionnelles ? Comment pourrait-on associer plus étroitement le monde médical, mais aussi les élus à la mise en place d'un plan collectif qui pourrait être rendu nécessaire par les circonstances ?
Associer les citoyens à la conception des politiques correspondantes est aujourd'hui indispensable. Les réflexions portant sur la santé publique sont souvent mal comprises : entre déni du risque, crise de confiance, parole imperturbable des experts, on s'aperçoit que le choix n'est pas seulement scientifique, mais politique.
Les méthodes statistiques utilisées pour évaluer la gravité d'une maladie pandémique sont souvent incompréhensibles. L'opinion publique n'a du reste pas réagi selon les prévisions des experts.
Il faut davantage tenir compte du contexte : la transparence est devenue une obligation ; les solutions nationales sont comparées avec celles retenues à l'étranger. Rien ne sert de minimiser les doutes : les doutes créent des craintes ; les craintes sont la source des rumeurs. Il vaut mieux se demander si ces doutes peuvent être justifiés, et si les choix effectués sont raisonnablement crédibles.
Un débat doit s'organiser entre citoyens et pouvoirs publics : les media peuvent le nourrir. Les hommes politiques peuvent en être les médiateurs.
Ce thème, comme celui de la réflexion sur une réponse progressive et modulable à une pandémie d'intensité moyenne servira de trame au rapport final qui conclura dans quelques mois les travaux de l'OPECST sur la mutation des virus et la gestion des pandémies.
PREMIERES RECOMMANDATIONS
1. Rester vigilant. Le virus circule et tue toujours. Les pandémies grippales peuvent comporter plusieurs vagues. Après un premier bilan à la fin de l'hiver dans l'hémisphère Nord, il faudra surveiller attentivement la situation dans l'hémisphère Sud.
2. Élaborer un plan de lutte contre une pandémie modérée, complémentaire du plan actuel, trop rigide et conçu pour une situation extrême. Envisager des phases intermédiaires entre les phases 5 et 6 permettant des mesures davantage proportionnées et graduées.
3. Mettre en place un dialogue avec les professions de santé pour les associer à la définition des mesures du nouveau plan pandémie.
4. Au sein de la coordination interministérielle, préciser les rôles respectifs des ministères de la Santé et de l'Intérieur, de manière à garantir que les préoccupations de nature médicale sont suffisamment prises en compte. Mettre en place une « Task Force » chargée de gérer la communication et d'anticiper les réponses à apporter aux rumeurs.
5. A l'issue de la pandémie, évaluer l'adaptation de la prise de décision et de la communication institutionnelle à la réalité de la situation, afin de tirer les leçons des réticences de l'opinion publique, mais aussi parfois du corps médical.
6. Favoriser la convergence des réseaux Sentinelles et GROG, et les recherches permettant une meilleure appréciation de la propagation et des effets des virus pandémiques.
7. Encourager les réseaux qui se mettent en place au niveau des universités et des centres de recherche, tant en France qu'en Europe et dans le monde pour coordonner leurs programmes.
8. Réfléchir aux implications des principes de précaution et de prévention en matière de santé publique, dans le contexte de la mondialisation et en tenant compte des solutions retenues à l'étranger.
9. Mettre en place un système permettant de repérer les populations sensibles et de les contacter. Engager des discussions à cette fin avec la CNIL.
10. Réfléchir au rôle et aux fonctions de l'EPRUS et au suivi de ses activités.
11. Évaluer au plan européen et au plan mondial l'efficacité des mesures prises et la manière dont les autorités sanitaires nationales ont coopéré entre elles et avec les institutions internationales.
12. Envisager que les collectivités d'Outre Mer puissent disposer de vaccins fabriqués dans l'hémisphère Sud, et notamment en Australie, étant donné l'évolution du virus dans les deux hémisphères.
13. Poser dès à présent publiquement la question du prochain vaccin, celui qui anticiperait l'arrivée du virus de l'automne prochain, sans renouveler en cercle fermé les erreurs passées.
EXAMEN DU RAPPORT PAR L'OFFICE
17 février 2010
M. Claude Birraux, député, président , a informé les membres de l'Office de l'état d'avancement du processus de renouvellement du conseil scientifique, ainsi que de la mise en place du quatrième partenariat avec l'académie des sciences.
Présentation du rapport d'étape sur « la mutation des virus et la gestion des pandémies »
M. Claude Birraux, député, président , a rappelé que l'étude confiée à M. Jean-Pierre Door et Mme Marie-Christine Blandin résultait d'une saisine de l'Office par la commission des affaires sociales de l'Assemblée nationale. Cette saisine, qui portait initialement sur la mutation des virus, a vu son objet étendu à la gestion des pandémies, à la suite de la présentation par les rapporteurs de leur étude de faisabilité, le 13 octobre dernier.
Après avoir également rappelé que les rapporteurs avaient organisé une audition publique ouverte à la presse, le 1 er décembre dernier, sur le thème « Face à la grippe A(H1N1) et à la mutation des virus, que peuvent faire chercheurs et pouvoirs publics ? », M. Claude Birraux, député, président , a indiqué que, dans un contexte marqué par plusieurs initiatives tendant à dresser le bilan de la campagne de vaccination contre cette grippe, les rapporteurs avaient souhaité présenter un rapport d'étape.
M. Jean-Pierre Door, député, rapporteur , a, tout d'abord, présenté l'état des connaissances et des recherches concernant les virus et leur mutation, en rappelant que les virus, nombreux, mutent constamment, de façon totalement imprévue et aléatoire. Ces mutations, parfois bénignes, peuvent néanmoins être la source de nombreuses complications tant chez l'homme que chez l'animal.
La recherche appliquée porte sur l'élaboration de nouveaux vaccins et de nouvelles techniques de production de vaccins, le renforcement de l'efficacité des vaccins en y ajoutant éventuellement des adjuvants, et la définition de nouveaux médicaments antiviraux.
L'acceptabilité du vaccin et de la vaccination par la population fait également l'objet d'études.
Puis, M. Jean-Pierre Door, député, rapporteur, a rappelé les différentes étapes de la pandémie et les décisions prises par les autorités publiques.
Les premières réactions à l'apparition en avril du nouveau virus grippal A(H1N1) ont été fortement influencées par les enseignements tirés de la grippe aviaire, les autorités s'étant fondées sur le plan officiel de lutte contre une pandémie qui avait été élaboré alors.
L'alarmisme des premiers jours a été suivi d'une phase d'observation qui a conduit l'OMS à déclarer un état de pandémie de niveau 6 - le niveau le plus élevé de son plan - le 11 juin. La France, pour sa part, a alors décidé de mettre en oeuvre des mesures correspondant à un niveau inférieur de gravité, afin de ne pas limiter inutilement les libertés publiques, tout en se laissant la possibilité d'élever son niveau de réaction si nécessaire.
Mi juillet, les scientifiques estimaient qu'un nouveau vaccin devrait être administré en deux doses, pour assurer son efficacité et, au vu des informations disponibles sur la diffusion du virus, les pouvoirs publics ont estimé qu'il fallait envisager de vacciner les deux tiers de la population française. C'est ainsi que 94 millions de doses de vaccins ont été commandées, dans un environnement totalement incertain.
Les souches vaccinales avaient été identifiées dès la fin avril, mais les laboratoires ne savaient pas encore quelle serait l'efficacité de leurs vaccins et à quelle date ils pourraient les livrer.
A partir de la fin août, plusieurs circulaires ont été élaborées pour organiser la vaccination : recours à des centres dédiés, ouverture, dans un premier temps de la vaccination aux catégories jugées prioritaires, et distribution de bons de vaccination.
La logique ayant prévalu s'est basée sur une situation de pénurie : on savait que les vaccins ne seraient disponibles que tardivement, ce qui a conduit à une autre décision ayant des conséquences importantes sur l'organisation de la vaccination : les vaccins seraient présentés par lot de dix doses, ce qui a impliqué d'utiliser un conservateur, le Thiomersal, critiqué par certains.
Aux Etats-Unis, les vaccins ont été fournis en vrac et par doses de 100 et, fin septembre, le principe d'une seule dose de 15 microgrammes a été retenu.
La population française, d'abord incertaine, puis niant la gravité potentielle du virus, a ensuite souhaité se faire vacciner même sans avoir reçu de bon de vaccination, puis est devenue indifférente.
5,6 millions de Français se sont fait vacciner, contre 60 millions de Chinois, 20% de la population aux Etats-Unis et 60% en Suède et au Canada.
M. Jean-Pierre Door, député, rapporteur, a observé que de nouvelles méthodes ont, au cours de la période considérée, vu le jour.
Si l'InVS a fait preuve d'une grande efficacité, la gestion de la grippe A(H1N1) a entraîné deux évolutions intéressantes de la veille et de la surveillance sanitaires : un rapprochement entre le réseau Sentinelles et les GROG, et l'émergence de nouveaux indicateurs de l'étendue d'une pandémie.
Par ailleurs, les techniques de production des vaccins se diversifient, et la mise au point d'un vaccin durable et plurivalent est vivement espérée.
Les vaccins sont, en effet, habituellement produits à partir d'une culture sur embryons d'oeufs de onze jours. Mais ils peuvent aussi être produits à partir de cultures cellulaires, à l'instar du vaccin livré en France par Baxter. Par ailleurs, les vaccins sont généralement produits à partir de virus inactivés. Cependant, un vaccin a été produit aux Etats-Unis sous forme de spray nasal grâce à des virus faiblement activés.
Dans l'Union européenne, où l'autorisation de mise sur le marché dépend de la Commission européenne sur recommandation de l'Agence européenne du médicament de Londres, tous les vaccins ont été produits en utilisant des adjuvants. Aux Etats-Unis, en revanche, aucun vaccin n'a été adjuvanté, comme c'est la tradition depuis toujours pour les vaccins contre la grippe. Les autorités sanitaires américaines n'excluent toutefois pas de recourir à l'utilisation d'adjuvants, si cela s'avérait nécessaire, notamment pour produire plus de vaccins ou pour leur conférer une plus grande efficacité.
Les scientifiques sont raisonnablement optimistes sur la possibilité de trouver dans les années qui viennent un vaccin qui durerait quelques années, contre les 18 mois actuels, et qui permettrait de lutter contre des virus grippaux différents.
La recherche visant à découvrir de nouveaux médicaments antiviraux doit devenir prioritaire. Sur les deux antiviraux efficaces contre le virus A(H1N1), un seul, le Tamiflu, est utilisé dans la pratique. Si l'on sait qu'il n'est efficace que dans les premières 48 heures de l'infection, de nombreuses questions se sont posées sur son utilisation à titre préventif, comme en Grande Bretagne, au risque de développer des résistances.
Mme Marie-Christine Blandin, sénatrice, rapporteure, a indiqué que le rapport d'étape se proposait de dresser un état des lieux propre à éclairer chacun et à dessiner des pistes pour le futur.
Dans le cas des virus grippaux, les mutations profitent d'organismes réservoirs à sang chaud (humains, oiseaux, porcs), ce qui devrait conduire à favoriser la pluridisciplinarité et les synergies avec les recherches sur la santé animale.
Lors de l'audition publique organisée par l'OPECST le 1 er décembre 2009, toutes les personnes occupant les plus hauts postes décisionnels dans les instances sanitaires ont été et restent unanimes pour recommander la vaccination massive.
Mais, la mise à l'écart des médecins généralistes a semé le doute, quelques voix dissonantes scientifiques ayant par ailleurs donné des arguments aux sceptiques.
Quelques erreurs ont, en outre, alimenté la contestation : médecins réquisitionnés d'autorité par des gendarmes, mauvaise recommandation du ministère de l'Intérieur sur le fractionnement de l'acte de vaccination, centres de vaccination tantôt déserts, tantôt embouteillés, refus de candidats non munis d'un bon.
Sur le terrain, la contestation s'est portée sur le choix ministériel du vaccin Glaxo Smith Kline, cultivé sur oeufs comme la majorité des vaccins, avec adjuvants. Le conditionnement dans des packs de dix a suscité une défiance accentuée par les échanges sur Internet, comme le fait que les femmes enceintes disposaient d'un vaccin sans adjuvant, ou le fait que les Etats-Unis ont de tout temps fait le choix de ne pas utiliser d'adjuvant.
Mme Marie-Christine Blandin, sénatrice, rapporteure, a cité plusieurs exemples de dysfonctionnements.
En Guyane, si les centres de santé ont été approvisionnés et si des équipes vaccinatrices se sont déplacées dans des villages reculés, dans certains cas, l'information a fait défaut. Ainsi, à Papaïchton, il n'y a eu que 8 vaccinés sur 4 000 habitants. En outre, l'accueil préalable à Saint Laurent du Maroni s'est déroulé sans garantie de confidentialité, et l'utilisation de langues locales a compromis la sincérité des réponses.
A La Réunion, les dates et souches pour les vaccins étaient les mêmes qu'en métropole, alors que l'île est située dans l'hémisphère Sud.
Mme Marie-Christine Blandin, sénatrice, rapporteure, a mis en évidence les caractéristiques de la stratégie de communication définie aux Etats-Unis qui ont opté pour un pilotage central et unique au niveau fédéral et ont décidé de ne pas utiliser d'adjuvant.
Par ailleurs, depuis le H5N1, les autorités américaines sont en contrat avec les entreprises pharmaceutiques qui leur fournissent chaque année les vaccins saisonniers. L'utilisation de ce cadre leur permet d'ajuster les quantités fabriquées.
Aux Etats-Unis, la stratégie de communication et la prise en compte de l'opinion publique constituent des éléments importants du dispositif de gestion. Une véritable Task Force pédagogique et interactive a été mise en place, avec des virologues, des médecins et des professionnels de la communication. Toutes les cibles à informer ont été inventoriées et des messages adaptés ont été diffusés. Tous les canaux sont utilisés (Twitter, You Tube, Face Book, mails, blogs, webcast, journaux, entreprises). Les informations fausses, les défiances, les questions sont systématiquement repérées et font l'objet de nouveaux arguments. Trois journées d'échange ont été organisées avec les journalistes. Un comité de suivi des conséquences des vaccinations, formé de citoyens volontaires, a été installé.
Abordant le système français de prise de décision, Mme Marie-Christine Blandin, sénatrice, rapporteure, a observé que le principe de précaution, à savoir prendre des mesures en supposant un risque probable, avait été évoqué à deux reprises : par la Ministre, pour justifier l'achat des vaccins, mais aussi par les internautes, pour contester le type de vaccin.
Dans le premier cas, l'application du principe ne pouvait être que partielle, puisqu'il porte en lui la recommandation de recherches pour en savoir plus, et que l'on ne pouvait pas attendre. De plus, la nature évolutive du risque (mutations possibles) compliquait l'évaluation. Les connaissances acquises au cours de la crise devraient permettre d'envisager une meilleure adaptabilité et une plus grande souplesse des plans relatifs aux pandémies.
Dans le second cas, la composition du vaccin GSK, avec le Thiomersal, a posé problème. Ce sel de mercure aux propriétés biocides, dont la masse est presque pour moitié composée de mercure, est utilisé, dans les préparations de l'industrie pharmaceutique, comme conservateur pour garantir l'absence de champignons et de bactéries. La présence de Thiomersal dans le vaccin A/H1N1 est en France directement liée à la commande en dix doses.
Après avoir rappelé que le Thiomersal est actuellement présent dans tous les vaccins contre la grippe, à des doses minimes, et qu'à ces doses, tout risque de toxicité est a priori exclu, Mme Marie-Christine Blandin, sénatrice, rapporteure, a estimé qu'en tout état de cause, le débat, le partage des informations, et l'énoncé des arbitrages à faire ont fait défaut, et souligné la nécessité de définir une stratégie de communication transparente et cohérente.
En voulant gagner du temps, les autorités de santé se sont précipitées pour des arbitrages en cercle restreint et des commandes massives, et elles se sont trop inspirées du plan autoritaire H5N1. Au contact du réel, la communication n'a pas suivi une ligne constante.
Les Français ont eu successivement plusieurs messages : danger maximal et nécessité vitale de se faire vacciner, puis, risque majeur pour les personnes sensibles et les enfants, et nécessité solidaire de se faire vacciner, pour protéger les autres. Simultanément, de nombreux professionnels de santé refusaient la vaccination et un nombre significatif de médecins généralistes ne militaient pas pour la vaccination.
Début janvier, dans la phase de généralisation, quand les Français « sans risque repéré » ont reçu les premiers bons, la Ministre a annoncé la revente de stocks et l'éventuelle négociation à la baisse avec les laboratoires des marchés de commande. Quelques jours plus tard, les généralistes ont été autorisés à vacciner. A peine le message renouvelé de la nécessité de se faire vacciner, le réseau Sentinelles a annoncé la fin de la pandémie, et le 25 janvier, le démontage des centres a été annoncé, alors qu'une majorité de Français « sains » venaient de recevoir leur bon.
En conclusion, Mme Marie-Christine Blandin, sénatrice, rapporteure , a noté que le virus A(H1N1) a pu au printemps 2009 représenter une menace massive et que son arrivée atypique, quelques années après la peur du H5N1, n'a pas manqué de mobiliser toute la chaîne de santé publique.
Par ailleurs, son évolution favorable, mais non prévisible, a contribué à la remise en cause des choix ministériels par une partie de l'opinion publique, ainsi qu'à un faible engouement pour se faire vacciner.
En outre, en suivant de trop près le plan H5N1 et en voulant économiser du temps, les autorités de santé n'ont pas entamé l'indispensable débat public, qui aurait pu améliorer les décisions, répondre aux exigences démocratiques, et créer la confiance.
M. Claude Birraux, député, président, après avoir souligné l'intérêt d'analyser les causes sociologiques des dysfonctionnements constatés, a posé des questions sur :
- la portée de la controverse suscitée par la gestion de la pandémie grippale, certains estimant justifiée l'application du « principe de précaution », tandis que d'autres considèrent que les pouvoirs publics ont fait preuve d'un excès de précaution, le terme de « démesure » ayant même été utilisé,
- le premier état des lieux pouvant être dressé des recherches et des partenariats en virologie et en vaccinologie en France,
- les tentatives menées par les pays membres de l'Union européenne pour harmoniser leurs politiques de gestion d'une pandémie, au-delà de la simple autorisation de mise sur le marché européen des vaccins,
- les effets d'une insuffisante information sur la nature et le rôle des adjuvants employés,
- les perspectives offertes par les médicaments antiviraux,
- le nombre de personnes ayant été vaccinées.
M. Jean-Pierre Door, député, rapporteur, a donné les précisions suivantes :
- En virologie, un suivi permanent est assuré au niveau mondial, le prélèvement et l'analyse des souches permettant d'étudier de manière approfondie les mutations constatées. En revanche, le domaine de la vaccinologie accuse un retard certain, en raison notamment du désengagement de l'industrie pharmaceutique de ce secteur de recherche. Cette situation s'est produite alors que les recherches en antibiothérapie n'ont pas conduit à des découvertes marquantes. Néanmoins, onze laboratoires ont mis au point des vaccins pour faire face à la pandémie.
- Le squalène, produit par le requin, est généralement utilisé comme adjuvant vaccinal. Ces adjuvants permettent à la fois de conserver les vaccins et, en améliorant l'efficacité de ceux-ci, de réduire les doses nécessaires.
- Le Tamiflu est le seul antiviral actuellement disponible. Il est utilisé au Japon pour traiter les cas de grippe classique, à la différence de la France qui l'a utilisé pour le H5N1 et le H1N1 parce qu'il n'y a pas d'autre antiviral. Cette situation, qui montre l'intérêt des recherches pouvant déboucher sur la découverte de nouveaux antiviraux, explique les efforts consentis dans ce domaine par les NIH aux Etats-Unis.
Mme Marie-Christine Blandin, sénatrice, rapporteure, a formulé les observations complémentaires suivantes :
- La crise a révélé la nécessité de mobiliser les fonds d'urgence dès la survenance d'un évènement inattendu.
- Les conditions dans lesquelles le Tamiflu a été utilisé - dans les 48 heures pour les personnes à risque, selon les orientations définies par l'OMS et la France, pour toutes les personnes et même certains animaux en Asie - suscitent des interrogations sur la portée réelle d'un système de gouvernance mondiale des pandémies.
- Au niveau européen, si les coopérations en matière de veille sont plus que satisfaisantes, la mise en oeuvre de stratégies coordonnées de recherches finalisées susceptibles de déboucher sur des découvertes brevetables s'avère beaucoup plus difficile.
- Aux Etats-Unis, où les experts rencontrés reconnaissent l'utilité des adjuvants et considèrent qu'ils ne présentent pas de danger, lesdits adjuvants ne sont pas utilisés car la population n'y est pas favorable.
M. Alain Gest, député, après avoir souligné l'impact des messages diffusés sur Internet, a souhaité recueillir l'avis des rapporteurs sur l'interprétation qu'il convient, dans le cas de la gestion de la pandémie grippale, de donner au principe de précaution, et sur la contestation des médecins qui ont mal accepté d'avoir été exclus du processus de vaccination.
M. Jean-Pierre Door, député, rapporteur, a indiqué que le choix opéré par le gouvernement, visant à confier les soins aux médecins et la vaccination à des centres dédiés, a reposé sur une série de considérations : le conditionnement en 10 doses, l'affluence dans les cabinets médicaux libéraux de patients infectés, les résultats de la consultation organisée par le Conseil de l'Ordre des médecins et les problèmes logistiques liés à l'existence de 57 000 cabinets médicaux répartis sur l'ensemble du territoire national.
Mme Marie-Christine Blandin, sénatrice, rapporteure, a observé que l'une des préconisations présentées propose de modifier les modes de communication et de prise de décision et souligné la nécessité d'organiser un débat préalable, comme en témoignent les difficultés ayant résulté du conditionnement en 10 doses.
M. Claude Gatignol, député, a demandé des précisions sur :
- les différences d'évolution de la pandémie selon les hémisphères,
- la situation aux Etats-Unis, tant en ce qui concerne les personnes habilitées à vacciner que la proportion de personnes vaccinées dans la population totale,
- la justification des questionnaires présentés aux personnes venant se faire vacciner et conditionnant l'accès à l'acte vaccinal,
- les raisons ayant conduit à écarter d'autorité les médecins et les infirmiers du processus vaccinal,
- le caractère tardif de la vaccination de la population scolarisée, alors que les jeunes étaient les plus atteints et que leur infection présentait des risques plus graves,
- l'état des connaissances en matière d'immunité qui permet de mieux apprécier le risque,
- l'absence de réaction des pouvoirs publics face aux rumeurs circulant sur Internet,
- le risque de voir désormais les vaccinations discréditées en dépit de leur utilité en matière de santé publique.
M. Jean-Pierre Brard, député, a estimé que la gestion de la pandémie ne devait pas conduire au procès de la prudence mais au procès du désordre.
Sous la pression des médias, des messages contradictoires ont été diffusés, cette cacophonie débouchant sur une remise en cause du consensus vaccinal. Les pouvoirs publics n'ont pas été capables de livrer un message clair et courageux. Parce que la vaccination permet de protéger les autres, la vaccination doit être obligatoire.
A cette situation irrationnelle, s'est ajoutée une mise en oeuvre désordonnée des moyens permettant à la population d'accéder à la vaccination. Les réquisitions ont ainsi parfois désorganisé les services hospitaliers en sous effectifs, alors que les services préfectoraux concernés n'ont pas jugé utile de faire appel aux médecins retraités.
Aucun bilan de la campagne de vaccination n'a été dressé. Aucune sanction n'a été prise.
Cette situation, comme d'autres crises précédentes, montre que le système français de gestion de crise est devenu défaillant.
Le non recours aux généralistes a été une erreur. Les collectivités locales ont été ignorées. Le faible taux de personnes vaccinées montre que les choix effectués n'ont pas été les bons.
Les recherches en virologie et en vaccinologie doivent être intensifiées et, pour ce faire, un prélèvement sur les bénéfices très importants tirés par l'industrie pharmaceutique de cette campagne de vaccination devrait être envisagé.
M. Gérard Bapt, député , après avoir déploré la multiplication des initiatives prises au sein du Parlement et portant sur la campagne de vaccination, a souligné le rôle joué par la presse qui, à plusieurs reprises, a donné des explications erronées tandis que les personnalités scientifiques restaient silencieuses. Puis il a demandé sur quelle base l'objectif de vacciner 2/3 ou 70% de la population a été établi.
M. Gilbert Barbier, sénateur, a formulé plusieurs observations :
L'organisation de la campagne de vaccination a été défaillante et il est nécessaire d'établir un bilan précis de la gestion de la pandémie.
L'exclusion des médecins du processus de vaccination s'explique également par le coût qui aurait pu en résulter pour l'assurance maladie, et le contexte, marqué par la renégociation de la convention médicale, a favorisé l'apparition de tensions entre le corps médical et les autorités publiques.
On peut s'interroger sur la pertinence du nombre de doses commandées, ainsi que sur le taux de personnes à vacciner pour arrêter la pandémie.
Les autorités ont hésité sur le nombre d'injections - un ou deux vaccins -, alors qu'aux Etats-Unis la vaccination unique a été choisie.
La médecine préventive ne peut que reposer sur les médecins.
M. Christian Bataille, député, a observé que les premières conclusions des rapporteurs conduisent à s'interroger sur les effets de la rumeur sur la population, l'échec du plan de vaccination reflétant un problème de société lié à l'attitude du public vis-à-vis de la science.
Répondant aux différents intervenants, M. Door, député, rapporteur, a donné les précisions suivantes :
Le délégué interministériel à la lutte contre la grippe aviaire reconnaît qu'il y a eu des expérimentations virtuelles sur le H5N1 dans plusieurs villes. Il va falloir élargir cette délégation et créer une véritable Task Force comparable au système anglais Cobra ou à la Task Force américaine.
Il faut redonner de la puissance à la vaccination, car le déni est ridicule. Les ligues anti-vaccinales sont actives, mais il y a eu plus de 10 000 morts aux Etats-Unis. Il ne faut pas faire le procès du désordre, car il a fallu aller très vite et mettre en oeuvre un plan qui n'existait que sous forme papier. La situation actuelle peut servir pour l'élaboration d'un nouveau plan.
Les experts virologues ont souligné qu'il fallait vacciner 2/3 de la population. Par la suite, les chiffres ont été minimisés, les scientifiques ayant montré que les personnes nées avant 1957 étaient partiellement immunisées. 15 millions de Français auraient été atteints par cette grippe.
Sur le nombre de doses, qu'aurait-on dit si on n'avait pas eu suffisamment de vaccins ?
Il faudra faire un bilan de l'activité des centres de vaccination. Dans le Loiret, la vaccination s'est déroulée correctement, grâce à des médecins retraités et des élèves infirmières.
Aux Etats-Unis, la vaccination s'est déroulée de manière différente : il n'y avait pas forcément de médecin présent ; le vaccin était souvent sous forme de spray nasal. En fait, l'organisation de la vaccination dépend du mode d'organisation de la médecine. En France, les médecins libéraux jouent un grand rôle, ce qui n'est pas le cas en Suède ou en Grande Bretagne.
Les bons de vaccination ont été distribués car il fallait privilégier certaines catégories de la population. Dans certains cas, seule la Sécurité Sociale disposait des informations nécessaires.
Certaines personnes auraient voulu se faire vacciner avant d'avoir reçu leur bon. Il aurait fallu davantage de souplesse dans les centres de vaccination.
Les différences d'évolution de la pandémie entre les deux hémisphères tiennent à la saison.
Dans les écoles, la règle suivie a été la fermeture d'une classe lorsqu'il y avait trois enfants malades.
Mme Marie-Christine Blandin, sénatrice, rapporteure , a fait les remarques suivantes :
Il était nécessaire en France de demander aux patients s'ils étaient allergiques à l'oeuf, car il y avait un vaccin de Baxter produit sans oeuf qui pouvait être utilisé.
Aux Etats-Unis, les vaccins ont été disponibles sous forme de 100 doses au niveau grossiste, mais en dose individuelle dans les lieux de vaccination.
La contagiosité a été plus importante pour les personnes ayant des difficultés respiratoires, et notamment les obèses, comme les personnes ayant eu une ablation d'un poumon mais qui ne prennent pas de ventoline.
Il faudrait que les experts indiquent par écrit quel pourcentage de la population il était nécessaire de vacciner.
Un bilan devra être fait sur le fonctionnement des centres de vaccination. Des études de sérologie devront par ailleurs être faites à partir de cohortes d'un millier de personnes pour savoir combien ont été touchées et ont acquis des anticorps.
Pour lutter contre la défiance vis-à-vis des vaccins, il faut surtout partager la culture scientifique.
M. Jean-Claude Etienne, sénateur, premier vice-président de l'OPECST , a félicité les rapporteurs pour le travail considérable qu'ils ont effectué, et souhaité que ce travail se prolonge.
Les précautions prises par les autorités ont été dues à l'incertitude et à la nécessité de prendre les précautions nécessaires. Il est préférable d'avoir des stocks de vaccins plutôt que d'en avoir manqué.
Il ne faut pas que ce qui a été vécu porte atteinte à la vaccination qui reste la base de toute conduite. La vaccinothérapie offre du reste aujourd'hui un espoir pour guérir le cancer. On peut se demander s'il faut rendre la vaccination obligatoire. Il peut certes y avoir des morts liées à la vaccination, mais il ne faut pas oublier qu'elle a permis de sauver beaucoup de patients dans le cas de la tuberculose.
Les solutions doivent être trouvées au niveau mondial par l'OMS. Il serait intéressant de définir de nouveaux indicateurs de pandémie.
Il faudrait enfin rapprocher les recherches sur la santé humaine et la santé animale qui sont actuellement trop séparées.
Les conclusions des rapporteurs ont été adoptées.
LISTE DES PERSONNES AUDITIONNÉES
I. Lors de la préparation de l'étude de faisabilité
Le mercredi 7 octobre 2009 :
M. le professeur François BRICAIRE, chef du service des maladies infectieuses et tropicales de l'hôpital de la Pitié-Salpêtrière à Paris.
M. Claude LE PEN, professeur d'université en sciences économiques à l'université de Paris-Dauphine.
M. Jean-Claude MANUGUERRA, responsable de la Cellule d'Intervention Biologique d'Urgence (CIBU) à l'Institut Pasteur.
Le mardi 13 octobre2009
M. Didier TABUTEAU, conseiller d'Etat, spécialiste des questions de santé et de sécurité sociale ; directeur général de la Fondation Caisses d'Epargne pour la solidarité et directeur de la Chaire Santé de l'IEP de Paris.
II. Après l'approbation de l'étude de faisabilité
A. A Paris, avant l'audition publique du 1° décembre
Le mardi 10 novembre 2009
MM. Philippe CHENE, président de Baxter France, Olivier GRUMEL, directeur des affaires publiques et gouvernementales de Baxter et Ludovic PERO, consultant en relations publiques (Affaires publiques consultants).
Le mardi 17 novembre 2009
M. le professeur Jean-François DELFRAISSY, directeur de l'Institut Microbiologie et Maladies infectieuses (IMMI), Inserm.
M. Jean-Marie COHEN, coordinateur national du réseau des GROG.
Le mardi 24 novembre 2009
Mme Françoise WEBER, directrice générale de l'Institut de veille sanitaire (InVS).
Le mercredi 25 novembre 2009
M. Patrick ROMESTANG, président de la section santé publique du Conseil national de l'Ordre des Médecins.
M. le Professeur Bruno LINA, directeur du centre national de référence contre la grippe (CNRG) pour le Sud de la France, délégué général du Groupe d'étude et d'information sur la grippe (GEIG), directeur du laboratoire de virologie et de pathologie humaine à Lyon.
M. Patrick ZYLBERMAN, historien de la médecine et de la santé publique, chargé de recherche au Centre de Recherche Médecine, Sciences, Santé et Société-CERMES.
M. Martial OLIVIER-KOEHRET, président de MG France.
M. Michel CHASSANG, président de la Confédération des Syndicats Médicaux Français.
B. A Paris, le mardi 1° décembre 2009
(Lors de l'audition publique ouverte à la presse« Face à la grippe A(H1N1) et à la mutation des virus, que peuvent faire chercheurs et pouvoirs publics ? ») :
M. le professeur François BRICAIRE, chef du service des maladies infectieuses et tropicales de l'hôpital de la Pitié-Salpêtrière à Paris.
M. Thierry PINEAU, chef du département de santé animale à l'INRA.
Mme Brigitte AUTRAN, professeur d'immunologie, co-directrice de l'Institut fédératif de recherche Immunité-cancer-infection, Paris.
M. Jean-Claude MANUGUERRA, responsable de la Cellule d'Intervention Biologique d'Urgence (CIBU) à l'Institut Pasteur.
M. le Professeur Antoine FLAHAUT, directeur de l'Ecole des hautes études en santé publique (EHESP).
M. le Professeur Bruno LINA, directeur du centre national de référence contre la grippe (CNRG) pour le Sud de la France, délégué général du Groupe d'étude et d'information sur la grippe (GEIG), directeur du laboratoire de virologie et de pathologie humaine à Lyon.
M. le Professeur Jean-François DELFRAISSY, directeur de l'Institut Microbiologie et Maladies infectieuses (IMMI), INSERM.
M. Thierry BLANCHON, responsable adjoint du réseau Sentinelles, INSERM.
M. Jean-Marie COHEN, coordinateur national du réseau des GROG.
M. Didier HOUSSIN, délégué interministériel à la lutte contre la grippe aviaire, directeur général de la santé.
M. Christian LAJOUX, président du LEEM (Les Entreprises du Médicament).
M. Claude LE PEN, professeur d'université en sciences économiques à l'université de Paris-Dauphine.
Mme Françoise WEBER, directrice générale de l'Institut de veille sanitaire (InVS).
M. Thierry COUDERT, directeur de l'EPRUS.
M. Michel COMBIER, président de l'UNOF-CSMF.
M. Patrick ZYLBERMAN, historien de la médecine et de oa santé publique, chargé de recherche au Centre de Recherche Médecine, Sciences, Santé et Société-CERMES.
M. Michel BOURGAIN, maire de l'Ile-Saint-Denis.
M. Bertrand MADELIN, directeur Santé Prévention Sécurité de Véolia Environnement.
M. Patrick ROMESTANG, président de la section santé publique du Conseil National de l'Ordre des Médecins.
M. Martial OLIVIER-KOEHRET, président de MG France.
M. Thierry AMOUROUX, secrétaire général du Syndicat des personnels infirmiers.
M. André CICOLELLA, porte parole du réseau Environnement-Santé
M. Dominique TRICARD, IGAS.
C. A La Réunion, du 14 au 16 décembre 2009
Auditions individuelles
M. Pierre-Henry MACCIONI, préfet de La Réunion.
M. Jean-François MONIOTTE , directeur de Cabinet du préfet de La Réunion.
M. Christian MEURIN, directeur régional des Affaires sanitaires et sociales de La Réunion (DRASS).
M. Arnaud MARTRENCHAR, directeur des services vétérinaires de La Réunion.
M. Koussay DELLAGI, directeur du CRVOI (Centre de recherche et de veille sur les maladies émergentes de l'Océan indien).
Mme Maya CESARI, élue au Conseil régional, déléguée aux secteurs innovants.
M. Philippe GASQUE, directeur du groupe de recherche sur les maladies infectieuses (Université de la Réunion, Centre biomédical CYROI, CHR Félix Guyon).
Mme Isabelle HENNEQUIN, journaliste à RFO.
Au Centre hospitalier régional Félix GUYON
M. Laurent BIEN, directeur régional.
Mme Marie-Christine JAFFAR-BANDJEE, microbiologiste.
Mme Marie-Pierre MOITON, praticien hospitalier - maladies infectieuses.
M. Bernard-Alex GAÜZERE, praticien hospitalier - réanimation.
M. Remy ALMAR, cadre supérieur de santé.
M. Guy HENRION, praticien hospitalier - SAMU Urgences.
M. Michel BOHRER, praticien hospitalier - DIM -, vice-président de la commission médicale d'établissement.
M. Patrick GRAS, directeur du site.
Mme Brigitte PETITJEAN, cadre NRBC (nucléaire, radiologique, biologique et chimique).
A la DRASS
M. Christian MEURIN, directeur de la DRASS de La Réunion.
Mme Gaëlle FOHR, ingénieur sanitaire.
M. Denis LERAT, inspecteur principal.
Mme Marion ARBES, médecin inspecteur régional.
M. Régis CORNU, pôle santé.
Mme Marie BAVILLE, ingénieur sanitaire DRASS, Lutte anti-vectorielle Réunion.
M. Julien THIRIA, ingénieur sanitaire (Mayotte).
M. Laurent FILLEUL, coordinateur scientifique CIRE Réunion-Mayotte.
M. Philippe RENAULT, médecin épidémiologiste, CIRE Réunion-Mayotte.
Au Groupe hospitalier Sud Réunion
M. Jean-Marie CHOPIN, directeur du GHSR.
M. Frederik STAINUWSKY, chef du service urgences.
M. Jean-Marie LEBON, directeur des soins.
M. Alain MICHAULT, chef de service Laboratoire de bactériologie, parasitologie, virologie, hygiène du GHSR.
M. Christian TREBUCHET, président CME du site sud du CHR.
Mme Josiane LENCLUME, attachée affaires générales et stratégie.
M. WINER, chef de service de réanimation.
M. POUBEAU, praticien hospitalier maladies infectieuses.
M. ARVIN-BEROD, responsable de pôle disciplines médicales, chef de service maladies infectieuses.
A l'Union régionale des Médecins Libéraux de La Réunion
M. François ANDRE, président, gastro-entérologue.
M. Robert ARNAUD, généraliste.
M. Christian LEMBA, gastro-entérologue.
M. Christian BETTOUM, immuno-allergologue.
M. Jérôme BRANSWYCK, généraliste.
M. Frédéric VASSAS, stomatologue.
M. Jean-Pierre LAURENT-GRANDPRE, ORL.
M. Bernard BODEN, chirurgien orthopédiste, président du département d'information médicale d'une clinique.
Rencontre avec les associations
Mme Françoise PAYET, présidente de l'association de quartier Philibert Commerson (quartier de Saint Denis).
Mme Blandine BOUVET, directrice de l'IREPS, Instance régionale d'éducation et de promotion de la santé.
Mme Nasrène SIDAT, adulte relais de l'association Réunion Insertion.
M. Richard MINATCHY, association Proxima.
M. Robert MOULALOU, Croix Rouge française.
M. Jean Alain CADET, association Citoyens contre le chik.
Mme Isabelle MARTIN, DRASS Réunion.
Mme Gaëlle FOHR, chargée de mobilisation sociale à la DRASS.
D. AUX ETATS-UNIS, du 11 au 13 janvier 2010
- Services diplomatiques français :
M. Pierre VIMONT, ambassadeur de France aux Etats-Unis.
M. Pascal LE DEUNFF, consul général et conseiller économique et commercial à Atlanta.
M. Jacques DRUCKER, conseiller santé à l'ambassade de France aux Etats-Unis.
M. Michel SCHAFFHAUSER, consul général à Washington.
- Aux CDC d'Atlanta :
Dr Stephen BLOUNT, directeur, Coordination Office for Global Health.
Dr Toby MERLIN, directeur adjoint, Influenza Coordination Unit.
Dr Scott SANTIBANEZ, technical chief of staff, CDC 2009 Influenza Response.
Dr. Nathaniel HUPERT, directeur, CDC Preparedness Modeling Unit.
Mme Emily EISENBERG , H1N1 Policy Unit.
Mme Marsha VANDERFORD, directeur, Emergency Communication System.
Dr Dan JERNIGAN, directeur adjoint, Influenza Division, NationalCenter for Immunization and Repiratory Diseases.
M. Ray ARTHUR, directeur, Global Disease Detection Operations Center.
M. Marc Alain WIDDOWSON, Influenza Division, Lead Iternational Epidemiology.
M. Jay BUTLER, directeur, Vax Task Force.
Mme Pascale WORTLEY, Implementation Team lead.
M. Tom SHIMABUKURO, adjoint, Vaccine Task Force.
M. Alexander KLIMOV , Influenza division.
M. David BROWNELL , chief of staff, vaccines (H1N1).
Mme Emily EISENBERG, H1N1 Policy Unit.
Mme Claudia VELLOZI, Vaccine Safety Team Lead.
M. John ISKANDER, Team lead, Antiviral Use.
M. Anthony FIORE, Medical Epidemiologist, Influenza division .
M. Jonathan KAPLAN, Task Force Lead .
Mme Anita PATEL, Strategic National Stockpile
M. Eugene McCRAY, deputy task force Lead
Mme Diane BENETT, Team Lead (clinical) Peramivir .
M. Steven ADAMS , deputy director, division of Strategic National Stockpile.
M. Richard SCHIEBER, Community Mitigation Unit.
Mme Emily KAHN, Community Mitigation Unit.
- Au US Department of Health and Human Services
Mme Mary Lisa MADELL, directeur, Office of Europe and Eurasia, Office of global Health Affairs.
M. Jose FERNANDEZ, Office of the Assistant Secretary for Preparedness and Response.
Dr Nicole LURIE, assistant Secretary for Preparedness and Response.
Dr Bill HALL, Office of Assistant Secretary for Public Affairs, News Office.
Dr Bruce GELLIN, directeur du National Vaccine Program.
-Aux National Institutes of Health (à Bethesda)
Pr Anthony FAUCI, directeur du National Institute of Allergy and Infectious Diseases.
Dr Richard GORMAN, associate Director for Clinical Research.
Dr Karl WESTERN, s enior International Scientific Advisor, National Institute of Allergy and Infectious Diseases .
- A la Food and Drug Administration
Mme Jean HU-PRIMMER , senior Regulatory Advisor, Office of Counterterrorism and Emerging Threats.
Mme Yelena SHNAYDER.
- Rencontre avec la communauté française de Washington
Dr Jean-Pierre FAURE, médecin agréé du consulat général et de l'ambassade.
M. Jérôme VACHER, président de l'association des français des IFI.
M. Lucien STERVINOU, vice-président de l'association des anciens combattants.
Mme Annie SEYS, présidente du Comité Tricolore.
M. Etienne DAILLY, chef d'escale d'Air France.
M. Eric VETEAU, proviseur du lycée français international Rochambeau.
* 1 Cette étude a été réalisée par l'Unité des virus émergents de l'Université d'Aix Marseille. Ses résultats ont été publiés sur Internet le 29 décembre 2009.







