Rapport n° 724 (2017-2018) de M. Jean SOL , fait au nom de la commission des affaires sociales, déposé le 25 septembre 2018
Disponible au format PDF (1,3 Moctet)
Tableau comparatif au format PDF (218 Koctets)
Synthèse du rapport (340 Koctets)
-
LES CONCLUSIONS DE LA COMMISSION DES AFFAIRES
SOCIALES
-
AVANT-PROPOS
-
EXPOSÉ GÉNÉRAL
-
I. LE SYSTÈME D'ÉVALUATION
ÉTHIQUE DES PROJETS DE RECHERCHE EN FRANCE
-
II. UN FONCTIONNEMENT DES COMITÉS DE
PROTECTION DES PERSONNES PERFECTIBLE
-
III. LA MODULATION DU TIRAGE AU SORT SELON LA
DISPONIBILITÉ ET LA COMPÉTENCE DES COMITÉS DE PROTECTION
DES PERSONNES
-
I. LE SYSTÈME D'ÉVALUATION
ÉTHIQUE DES PROJETS DE RECHERCHE EN FRANCE
-
EXAMEN DE L'ARTICLE UNIQUE
-
EXAMEN EN COMMISSION
-
LISTE DES PERSONNES ENTENDUES
ET DÉPLACEMENT
N° 724
SÉNAT
SESSION EXTRAORDINAIRE DE 2017-2018
|
Enregistré à la Présidence du Sénat le 25 septembre 2018 |
RAPPORT
FAIT
au nom de la commission des affaires sociales (1) sur la proposition de loi, ADOPTÉE PAR L'ASSEMBLÉE NATIONALE, relative à la désignation aléatoire des comités de protection des personnes ,
Par M. Jean SOL,
Sénateur
Procédure de législation en commission,
en application de l'article 47 ter du Règlement
|
(1) Cette commission est composée de : M. Alain Milon , président ; M. Jean-Marie Vanlerenberghe , rapporteur général ; MM. René-Paul Savary, Gérard Dériot, Mme Colette Giudicelli, M. Yves Daudigny, Mmes Michelle Meunier, Élisabeth Doineau, MM. Michel Amiel, Guillaume Arnell, Mme Laurence Cohen, M. Daniel Chasseing , vice-présidents ; M. Michel Forissier, Mmes Pascale Gruny, Corinne Imbert, Corinne Féret, M. Olivier Henno , secrétaires ; Mme Cathy Apourceau-Poly, M. Stéphane Artano, Mmes Martine Berthet, Christine Bonfanti-Dossat, MM. Bernard Bonne, Jean-Noël Cardoux, Mmes Annie Delmont-Koropoulis, Catherine Deroche, Chantal Deseyne, Nassimah Dindar, Catherine Fournier, Frédérique Gerbaud, M. Bruno Gilles, Mmes Nadine Grelet-Certenais, Jocelyne Guidez, Véronique Guillotin, Victoire Jasmin, M. Bernard Jomier, Mme Florence Lassarade, M. Martin Lévrier, Mmes Marie-Noëlle Lienemann, Monique Lubin, Viviane Malet, Brigitte Micouleau, MM. Jean-Marie Mizzon, Jean-Marie Morisset, Philippe Mouiller, Mmes Frédérique Puissat, Laurence Rossignol, Patricia Schillinger, M. Jean Sol, Mme Claudine Thomas, M. Jean-Louis Tourenne, Mme Sabine Van Heghe . |
Voir les numéros :
|
Assemblée nationale ( 15 ème législ.) : |
847 , 908 et T.A. 118 |
|
|
Sénat : |
489 et 725 (2017-2018) |
|
|
La commission a examiné cette proposition de loi selon
la procédure de législation en commission, en application de
l'article 47
ter
du Règlement.
|
LES CONCLUSIONS DE LA COMMISSION DES AFFAIRES SOCIALESRéunie le mardi 25 septembre 2018 sous la présidence de M. Alain Milon , président, la commission des affaires sociales a examiné selon la procédure de législation en commission (articles 47 ter à 47 quinquies du règlement), sur le rapport de M. Jean Sol , la proposition de loi n° 489 (2017- 2018), adoptée par l'Assemblée nationale, relative à la désignation aléatoire des comités de protection des personnes . Face aux difficultés rencontrées par les comités de protection des personnes (CPP) pour procéder à l'évaluation éthique des projets de recherche dans des délais compatibles avec les exigences réglementaires européennes, ce texte propose de moduler le tirage au sort des CPP afin qu'il tienne compte, pour l'attribution d'un dossier de recherche, de leur disponibilité et de leur compétence dans le domaine concerné. Votre commission estime que la modulation envisagée est de nature, au moins à titre transitoire, à fluidifier le traitement des dossiers pour des CPP confrontés à l'augmentation de leur charge de travail et des obstacles dans la mobilisation d'experts dans certaines spécialités. Une plus grande agilité du système d'évaluation scientifique et éthique s'impose dans un contexte où, à compter de l'entrée en vigueur en 2020 du règlement européen relatif aux essais cliniques de médicaments, le dépassement du délai réglementaire vaudra désormais accord tacite et non plus rejet. Dans l'intérêt des volontaires, il est inconcevable que des projets de recherche puissent être entrepris en l'absence de décision explicite quant à leur caractère éthique. Comme l'a souligné le rapporteur, l'adoption conforme de cette proposition de loi permettrait une plus grande réactivité des CPP dans l'examen des dossiers de recherche et participerait ainsi de la stratégie déployée par notre pays pour retrouver son rang dans la recherche clinique mondiale. Suivant l'avis de son rapporteur, la commission a adopté la proposition de loi sans modification . |
AVANT-PROPOS
Mesdames, Messieurs,
Le 17 mai 2018, l'Assemblée nationale a adopté en première lecture la proposition de loi relative à la désignation aléatoire des comités de protection des personnes (CPP) 1 ( * ) .
Introduite à l'initiative de la commission des affaires sociales du Sénat dans la loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine, dite « loi Jardé », la désignation aléatoire des CPP visait à garantir l'indépendance de l'évaluation éthique des projets de recherche, dans un contexte marqué par le scandale du Mediator et les soupçons nés de rapports d'intérêt et de proximité présumés entre promoteurs d'essais cliniques et membres de CPP.
Partant du constat que tous les CPP ne sont pas en capacité d'examiner, dans des délais raisonnables, l'ensemble des projets de recherche qui leur sont soumis, la proposition de loi, dans sa rédaction adoptée par l'Assemblée nationale, tend à moduler la procédure de désignation au tirage au sort des CPP selon leur disponibilité et leur compétence.
Plusieurs éléments semblent plaider pour une adaptation de la procédure de tirage au sort des CPP. La concurrence internationale dans le domaine des essais cliniques s'intensifie, à l'heure où l'Union européenne s'apprête à réduire les délais d'évaluation scientifique et éthique à partir de 2020 pour les médicaments et 2022 pour les dispositifs médicaux. Dans le même temps, l'allongement des délais d'examen par les CPP depuis la mise en oeuvre du tirage au sort peut peser sur le positionnement de notre pays dans la recherche clinique mondiale et représenter une perte de chance pour les patients dans l'accès au progrès médical.
Partageant l'objectif d'une plus grande réactivité des CPP dans l'examen des projets de recherche, votre commission a adopté la présente proposition de loi sans modification. Elle demeure néanmoins attentive aux conditions de mise en oeuvre d'une modulation du tirage au sort selon les critères de disponibilité et de compétence qui ne saurait conduire à une spécialisation définitive des CPP, au risque de remettre en cause la qualité et l'indépendance de l'évaluation éthique française, mondialement reconnues.
EXPOSÉ GÉNÉRAL
I. LE SYSTÈME D'ÉVALUATION ÉTHIQUE DES PROJETS DE RECHERCHE EN FRANCE
A. LES MISSIONS ET LE FONCTIONNEMENT DES COMITÉS DE PROTECTION DES PERSONNES
1. Les différents types de projets de recherche examinés par les CPP
Les CPP ont été institués par la loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique, en lieu et place des anciens comités consultatifs de protection des personnes dans la recherche biomédicale (CCPPRB), créés par la loi n° 88-1138 du 20 décembre 1988 relative à la protection des personnes qui se prêtent à des recherches biomédicales, dite « loi Huriet-Sérusclat ».
La « loi Jardé », modifiée par l'ordonnance n° 2016-800 du 16 juin 2016 2 ( * ) , a précisé et renforcé le cadre juridique applicable à la « recherche impliquant la personne humaine », termes qui se sont substitués à la notion de recherche biomédicale et recouvrent tous les essais ou expérimentations organisés et pratiqués sur l'être humain en vue du développement des connaissances biologiques ou médicales.
Parmi les recherches impliquant la personne humaine, le code de la santé publique 3 ( * ) distingue :
- les recherches interventionnelles de catégorie I qui comportent une intervention sur la personne non justifiée par sa prise en charge habituelle. En grande majorité des essais cliniques, les recherches interventionnelles recouvrent tous les projets de recherche de médicaments et la recherche biomédicale non dénuée de risque pour les personnes qui y participent 4 ( * ) . Leur mise en oeuvre est également subordonnée à l'autorisation de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) 5 ( * ) ;
- les recherches interventionnelles de catégorie II qui ne comportent que des risques et des contraintes minimes, dont la liste est fixée par arrêté du ministre chargé de la santé après avis du directeur général de l'ANSM 6 ( * ) ;
- les recherches non interventionnelles de catégorie III qui ne comportent aucun risque ni contrainte et dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle. Elles comportent une dimension essentiellement observationnelle et prospective et n'impliquent aucune intervention dans la prise en charge habituelle du patient 7 ( * ) .
Si les recherches interventionnelles constituaient initialement l'essentiel des dossiers examinés par les CPP, la part des projets de recherche des catégories II et III a fortement progressé à partir de 2017. L'ordonnance n° 2016-800 du 16 juin 2016 a en effet élargi le champ des CPP aux recherches non interventionnelles, qui relevaient auparavant du comité consultatif sur le traitement de l'information en matière de recherche (CCTIRS).
Répartition des dossiers initiaux 8 ( * ) de recherche par catégorie entre 2012 et 2017
|
Année |
RBM 9 ( * ) /I |
Soins courants/II |
Collections/III |
Total |
|||
|
% |
Nombre de dossiers |
% |
Nombre de dossiers |
% |
Nombre de dossiers |
Nombre de dossiers |
|
|
2012 |
76 % |
1 996 |
10 % |
261 |
14 % |
366 |
2 623 |
|
2013 |
74 % |
1 967 |
14 % |
369 |
12 % |
310 |
2 646 |
|
2014 |
70 % |
1 995 |
14 % |
395 |
16 % |
446 |
2 836 |
|
2015 |
71 % |
2 018 |
16 % |
457 |
13 % |
369 |
2 844 |
|
2016 |
66 % |
1 908 |
18 % |
502 |
16 % |
463 |
2 873 |
|
2017 |
40 % |
1 183 |
31 % |
909 |
29 % |
865 |
2 957 |
Source : Conférence nationale des comités de protection des personnes.
2. Le rôle des comités de protection des personnes
Jusqu'à l'entrée en vigueur des dispositions du règlement (UE) n° 536/2014 10 ( * ) relatif aux essais cliniques de médicaments, les CPP analysent les projets de recherche qui leur sont soumis selon une approche à la fois :
- éthique : les CPP déterminent si les protocoles envisagés sont de nature à préserver les droits, la sécurité et le bien-être des participants 11 ( * ) ;
- scientifique : les CPP évaluent également la méthodologie et la pertinence de la recherche 12 ( * ) .
Lorsqu'elle se prononce sur l'autorisation d'un projet de recherche impliquant la personne humaine sur un médicament ou un produit de santé, l'ANSM procède, pour sa part, à une évaluation scientifique du protocole envisagé.
Le règlement (UE) n° 536/2014 devrait entrer en application six mois après la mise en service du portail européen centralisant l'ensemble des informations utiles qui concernent un projet d'essai clinique de médicament : plusieurs fois reportée, celle-ci est désormais prévue courant 2020. Ce règlement institue une procédure d'examen des projets d'essais cliniques de médicaments commune à tous les États membres comprenant une évaluation en deux parties, l'une consacrée à l'évaluation scientifique (dite « partie I »), l'autre consacrée à l'évaluation éthique (dite « partie II »).
Dans ce contexte, l'ordonnance n° 2016-800 du 16 juin 2016 a introduit dans le code de la santé publique un chapitre 13 ( * ) dédié aux essais cliniques de médicaments sous le régime du règlement (UE) n° 536/2014. Lorsque ce dernier entrera en vigueur, l'évaluation scientifique de l'essai clinique, et par suite de sa méthodologie, sera confiée à l'ANSM et son évaluation strictement éthique sera conduite par un CPP. De l'avis de l'ensemble des représentants de CPP auditionnés par le rapporteur de votre commission, les comités ne pourront néanmoins faire l'économie d'une analyse de la méthodologie envisagée, en rappelant que « tout ce qui n'est pas scientifique n'est pas éthique », pour reprendre l'aphorisme prêté au professeur Jean Bernard 14 ( * ) .
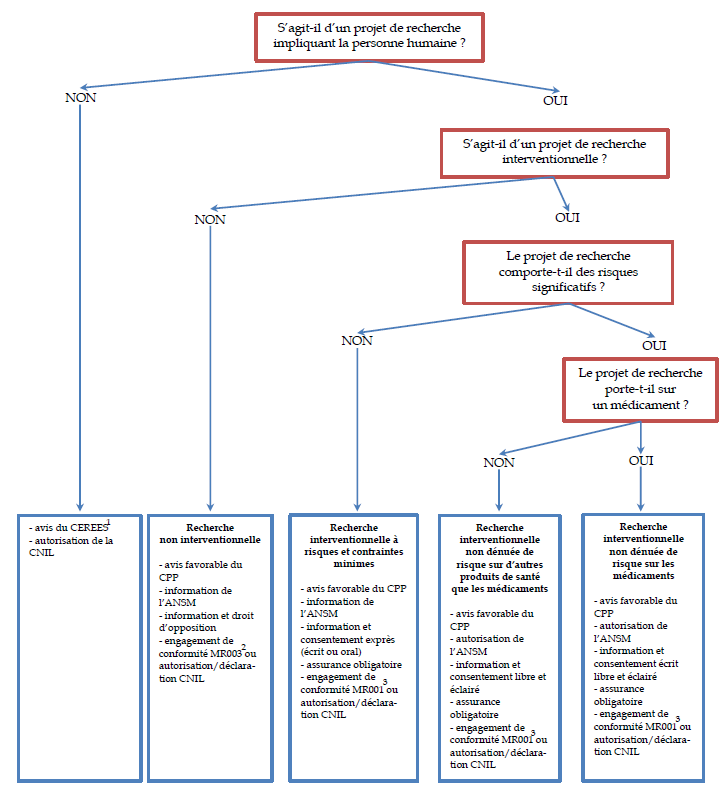
Les conditions d'examen d'un projet de recherche peuvent être résumées par le schéma suivant :
Les conditions d'examen d'un projet de
recherche
impliquant la personne humaine
Source : A partir de l'Inserm et de Caroline QUINTIN, « Les recherches impliquant la personne humaine - De la loi de santé publique à la loi Jardé », unité de recherche clinique Paris Nord Val de Seine, 17 février 2017.
3. La composition et la désignation des CPP
Conformément à l'article L. 1123-2 du code de la santé publique, la composition des CPP doit garantir leur indépendance et la diversité des compétences dans le domaine de la recherche impliquant la personne humaine ainsi qu'à l'égard des questions éthiques, sociales, psychologiques et juridiques.
Chaque CPP comprend ainsi 14 membres titulaires 15 ( * ) répartis en deux collèges 16 ( * ) :
- un collège de 7 personnes compétentes sur les aspects scientifiques et médicaux, comprenant des personnes qualifiées en matière non seulement de recherche biomédicale mais également de biostatistique ou d'épidémiologie, un médecin généraliste, un pharmacien hospitalier et un infirmier ;
- un collège de 7 personnes compétentes sur les aspects éthiques, juridiques et psychosociaux, comprenant une personne qualifiée en raison de sa compétence sur les questions d'éthique, un psychologue, un travailleur social, deux personnes qualifiées en raison de leur compétence dans le domaine juridique et deux représentants des associations de malades et d'usagers du système de santé.
Le mandat des membres des comités est d'une durée de trois ans, renouvelable, et prend fin au terme de l'agrément du comité. Les membres du comité sont nommés par le directeur de l'agence régionale de santé (ARS) de son ressort territorial, à la suite d'un appel à candidatures pour chacune des catégories précitées.
Les CPP peuvent s'adjoindre le concours, sans voix délibérative, d'experts dont la compétence est jugée nécessaire compte tenu des spécificités du projet de recherche. En outre, pour cinq types de recherche, la présence de spécialistes est obligatoire si le comité n'en comprend pas déjà en son sein. Le CPP doit ainsi solliciter l'expertise :
- lorsque le projet de recherche porte sur des personnes mineures de moins de 16 ans, d'un pédiatre, avec voix délibérative 17 ( * ) ;
- lorsque le projet de recherche porte sur des personnes majeures hors d'état d'exprimer leur consentement, un spécialiste, avec voix délibérative, des droits des majeurs protégés et ayant une connaissance des spécificités de la maladie concernée 18 ( * ) ;
- lorsque le projet de recherche porte sur un produit de santé émettant ou mettant en oeuvre des rayonnements ionisants, un spécialiste en radioprotection, sans voix délibérative 19 ( * ) ;
- lorsque le projet de recherche porte sur la première administration à ou la première utilisation chez l'homme d'un produit de santé, un spécialiste des essais de phase I, sans voix délibérative 20 ( * ) ;
- lorsque le projet de recherche porte sur la procréation médicalement assistée (PMA), un spécialiste de l'assistance à procréation, sans voix délibérative 21 ( * ) .
Les CPP sont dotés de la personnalité juridique de droit public et leurs ressources sont constituées par une dotation de l'État. Dans la loi de finances pour 2018, 3,3 millions d'euros ont été alloués au financement des CPP au titre du programme 204 « Prévention, sécurité sanitaire et offre de soins » de la mission « Santé ».
La mise en oeuvre du tirage au sort n'est opérationnelle que depuis le 17 novembre 2016, sans doute précipitée par l'essai clinique qui avait conduit à la mort d'un patient par lésion cérébrale au centre Biotrial de Rennes en janvier 2016. La perspective de l'adoption d'un règlement européen encadrant les essais cliniques de médicaments avait initialement conduit le Gouvernement à temporiser dans l'application de la « loi Jardé ».
Depuis cette date, la désignation du CPP chargé d'instruire un projet de recherche est réalisée par tirage au sort par le secrétariat de la commission nationale des recherches impliquant la personne humaine (Cnriph) 22 ( * ) , assuré par la direction générale de la santé (DGS) du ministère de la santé. En pratique, le promoteur d'un projet de recherche saisit son dossier de recherche via son compte personnel créé sur le système d'information des recherches impliquant la personne humaine (SI RIPH), opérationnel depuis le 2 juillet 2018. À l'issue de la saisie, le SI RIPH déclenche automatiquement le tirage au sort du CPP et un message électronique est adressé au promoteur lui indiquant le CPP désigné.
Avant l'introduction du tirage au sort, le CPP sélectionné était nécessairement l'un des CPP de l'interrégion dans laquelle exerçait le promoteur ou l'investigateur coordonnateur du projet de recherche. Dans le cadre de la procédure de tirage au sort, les CPP sont désormais désignés sur une base nationale. La France compte 39 CPP 23 ( * ) , agréés par le ministre chargé de la santé tous les six ans, répartis entre 7 interrégions de recherche clinique : 10 en Île-de-France, 6 dans l'interrégion Sud-Est, 6 dans l'interrégion Ouest, 5 dans l'interrégion Sud-Méditerranée, 4 dans l'interrégion Nord-Ouest, 4 dans l'interrégion Est et 4 dans l'interrégion Sud-Ouest et Antilles-Guyane-Réunion.
En cas d'avis défavorable du CPP, le promoteur peut solliciter du ministre chargé de la santé un second avis qui sera rendu par un CPP également tiré au sort.
B. LA QUALITÉ DE L'ÉVALUATION SCIENTIFIQUE ET ÉTHIQUE DES ESSAIS CLINIQUES, UN ENJEU HAUTEMENT CONCURRENTIEL
Selon les données extraites du SI RIPH, trois grands domaines de la recherche clinique représentent plus de 35 % de l'ensemble des dossiers déposés : l'oncologie (14 %), la neurologie/anesthésie (14,4 %) et la rhumatologie/orthopédie (7 %). Selon les données transmises par l'ANSM, la répartition, en 2017, des projets d'essai clinique de médicaments par aires thérapeutiques est la suivante :
Les domaines d'intervention des essais cliniques de médicaments en 2017
|
54 % |
Oncologie/hématologie |
Médicaments en hématologie, immuno-transplantation, néphrologie |
|
Médicaments en oncologie |
||
|
Hémovigilance, produits sanguins
labiles,
|
||
|
19 % |
Cardiologie/Rhumatologie/
|
Médicaments en cardiovasculaire, thrombose, métabolisme, rhumatologie, stomatologie |
|
Médicaments en endocrinologie, gynécologie, urologie, pneumologie, ORL, allergologie |
||
|
11 % |
Neurologie/anesthésie |
Médicaments en neurologie,
psychiatrie,
|
|
Médicaments en antalgie,
|
||
|
Médicaments stupéfiants, psychotropes
|
||
|
16 % |
Infectiologie/hépatologie/
|
Médicaments de virologie et thérapie génique |
|
Vaccins et médicaments antibiotiques,
|
||
|
Médicaments en dermatologie,
hépato-gastroentérologie
|
Source : Agence nationale de sécurité du médicament et des produits de santé
L'implantation d'essais cliniques représente un enjeu d'attractivité au niveau international, et tout particulièrement au sein de l'Union européenne. L'expérimentation de thérapies innovantes, notamment la thérapie génique et cellulaire et l'immunothérapie, contribue au prestige des établissements hospitaliers qui les mettent en oeuvre et de leurs équipes médicales. Elle suscite également un fort espoir chez des malades qui, après l'échec des thérapies traditionnelles, demeurent en attente d'un traitement de dernière intention pour des pathologies complexes.
À titre d'exemple, face aux limites des chimiothérapies pour certains malades atteints de cancers rares, les nouvelles immunothérapies constituent une voie de traitement prometteuse, en particulier des cancers pédiatriques : les hôpitaux Saint-Louis et Robert-Debré ont ainsi reçu en août 2018 le label « centre expert » pour la prise en charge de jeunes patients par CAR 24 ( * ) T-Cells , une thérapie génique consistant à reprogrammer génétiquement les lymphocytes T des malades dans le traitement de la leucémie aiguë lymphoblastique.
Traditionnellement reconnue au niveau mondial pour la qualité de ses évaluations scientifiques et éthiques et ses performances en recherche clinique, la France voit désormais son attractivité dans l'implantation d'essais cliniques en débat.
Les promoteurs industriels redoutent que l'incapacité des CPP à examiner les dossiers qui leur sont soumis dans des délais raisonnables compromette le déploiement en France des projets de recherche les plus innovants. À partir de l'entrée en vigueur du règlement (UE) n° 536/2014, le choix par le promoteur de l'État membre rapporteur sur son projet devrait accentuer la concurrence entre pays européens. Plusieurs pays voisins, dont l'Allemagne, la Belgique, le Danemark et l'Espagne, se sont déjà employés à réorganiser leur système d'évaluation scientifique et éthique afin de les rendre plus « agiles » dans le traitement des dossiers. Le critère de « délais optimisés et compétitifs », selon les termes du syndicat professionnel des entreprises du médicament, le Leem, est identifié par les industriels comme déterminant dans le choix des États d'implantation des essais cliniques.
|
Les systèmes d'évaluation scientifique et éthique dans quelques pays européens Aux Pays-Bas et en Belgique, les avis éthiques sont pris auprès de différents comités régionaux par un comité national qui fait le lien avec l'autorité réglementaire pour rendre un avis commun. L'Agence fédérale des médicaments et des produits de santé (AFMPS) belge a lancé une phase pilote avec les comités d'éthique en vue d'aboutir, pour l'agence, à un délai de 15 jours (soit un délai trois fois plus court que celui fixé à l'ANSM) pour les essais cliniques mono-centriques de phase I et de 28 jours pour les autres essais cliniques, en dehors d'un éventuel « clock-stop » de maximum un mois 25 ( * ) . Le Danemark, la Slovénie, la Suède et le Portugal ont décidé de la création d'un comité d'éthique national dédié à l'évaluation des essais cliniques interventionnels, avec un degré variable de coordination et de consolidation avec l'autorité réglementaire. En Allemagne, l'évaluation est décentralisée auprès de comités régionaux habilités, avec une consolidation des avis et une décision effectuées par l'autorité réglementaire. L'agrément des comités d'éthique pour l'évaluation d'essais cliniques de médicaments met l'accent sur la compétence, la capacité à se réunir et l'accès à des ressources externes en expertise à travers un réseau déjà constitué. Les comités d'éthiques sont impliqués pour les aspects de l'évaluation clinique mais la doctrine d'évaluation et les templates sont sous la responsabilité de l'autorité réglementaire. |
Source : Agence nationale de sécurité du médicament et des produits de santé
Cette approche de l'attractivité par le prisme des délais doit néanmoins être nuancée. La qualité de l'examen scientifique et éthique reste essentielle pour nombre d'entreprises peu enclines à risquer leur réputation dans des projets de recherche labellisés « au rabais ». En outre, la France dispose d'arguments solides pour attirer les recherches tant interventionnelles qu'observationnelles : des équipes médicales de renom bien intégrées dans le tissu de la recherche universitaire, des universités et organismes de recherche solidement positionnés dans le programme-cadre européen « Horizon 2020 » et le programme national des investissements d'avenir (PIA), ainsi que des bases de données cliniques d'une ampleur inégalée en Europe au travers des ressources de la Caisse nationale de l'assurance maladie (Cnam) et des groupements hospitaliers publics.
Le Leem constate néanmoins une diminution du nombre d'essais cliniques autorisés par l'ANSM de l'ordre de 18 % entre 2015 et 2016 et souligne un recul plus prononcé en France des essais de médicaments promus par les industriels que dans d'autres pays 26 ( * ) . Pour leur part, les représentants des industriels dans les domaines des dispositifs médicaux et des biotechnologies considèrent le système d'évaluation éthique français comme pénalisant pour de petites entreprises, généralement des start-ups dont l'équilibre financier est étroitement lié au lancement d'essais cliniques.
Le syndicat national de l'industrie des technologies de santé (Snitem) et l'association France Biotech ont ainsi évoqué plusieurs cas de projets de recherche retardés ou « retoqués » par des CPP en France, quand ces mêmes projets avaient été validés et, pour certains, étaient déjà entrés dans une phase opérationnelle dans d'autres pays tels que le Royaume-Uni et l'Irlande.
Les représentants des promoteurs institutionnels restent plus optimistes sur le positionnement de la France dans la recherche clinique mondiale. La coordination des promoteurs institutionnels (CPI) indique ne pas avoir constaté de diminution du nombre d'essais cliniques auxquels les promoteurs académiques ont participé en France. Ils soulignent, au contraire, la multiplication de projets d'envergure européenne impliquant la France et ses organismes de recherche. L'Institut national de la santé et de la recherche médicale (Inserm) souligne que d'autres facteurs, au-delà des délais d'évaluation préalable, jouent en faveur de la France, notamment le développement de réseaux d'investigateurs 27 ( * ) emmenés par des leaders reconnus dans leur discipline. Lors de l'examen de la présente proposition de loi en séance publique à l'Assemblée nationale, la ministre des solidarités et de la santé a rappelé que 30 % des essais cliniques en France impliquaient aujourd'hui les promoteurs académiques.
Parmi les mesures du 8 e conseil stratégique des industries de santé (Csis), annoncées le 10 juillet 2018, la première porte spécifiquement sur l'accélération des procédures d'autorisation d'essais cliniques en France. Le Gouvernement a ainsi fixé un objectif de délai maximal de 60 jours pour les CPP, en misant sur « un ensemble d'actions d'amélioration du fonctionnement des CPP pilotées par la commission nationale des recherches impliquant la personne humaine ». Cet objectif est de 45 jours pour l'ANSM pour les médicaments et dispositifs médicaux et de 110 jours pour les médicaments de thérapie innovante.
L'ANSM a indiqué avoir déjà mis en oeuvre différentes mesures volontaristes de redressement 28 ( * ) , qui ont permis une nette amélioration en des délais de notification, bien en-deçà des délais règlementaires en moyenne et en médiane. En juin 2018, les délais moyens de l'ANSM pour les autorisations d'essai clinique de médicament s'établissent ainsi à 51 jours, soit une progression de 12 jours en six mois.
Les efforts de l'ANSM et des CPP devront s'intensifier dans la perspective de l'entrée en vigueur des règlements européens relatifs aux essais cliniques de médicaments en 2020 et aux dispositifs médicaux et dispositifs médicaux de diagnostic in vitro 29 ( * ) en 2022 30 ( * ) .
II. UN FONCTIONNEMENT DES COMITÉS DE PROTECTION DES PERSONNES PERFECTIBLE
A. LES CONSÉQUENCES DE LA MISE EN oeUVRE DU TIRAGE AU SORT
1. Une déconcentration de la charge de travail entre CPP, mais un nombre de dossiers en augmentation
Le lissage du nombre de dossiers examinés par chaque CPP a constitué le premier effet, mécanique, de la procédure de tirage au sort. Une enquête de 2016 du Leem établissait que 50 % des études cliniques étaient évaluées par 9 des 40 CPP 31 ( * ) . Pour l'année 2017, 18 CPP ont traité 50 % des dossiers qui leur ont été soumis. Le tirage au sort a en effet permis une répartition plus uniforme de la charge de travail entre CPP, avec une médiane par CPP de 90 32 ( * ) dossiers initiaux 33 ( * ) selon les données de la Cnriph.
Cette répartition plus équilibrée des dossiers entre CPP est bienvenue dans un contexte d'augmentation du nombre de projets de recherche déposés par les promoteurs. La Cnriph a observé en effet une hausse de 9 % du nombre de dossiers initiaux sur les huit premiers mois de 2018. Cette progression est, en partie, alimentée par :
- le transfert depuis novembre 2016 aux CPP des recherches non interventionnelles ;
- l'augmentation des modifications substantielles dans un contexte de fragmentation croissante des phases d'expérimentation d'un produit de santé, les phases les plus complexes à analyser pour les CPP demeurant la phase 1 (première administration) et la phase 2a (démonstration de l'efficacité du médicament).
2. La question des délais d'examen des dossiers
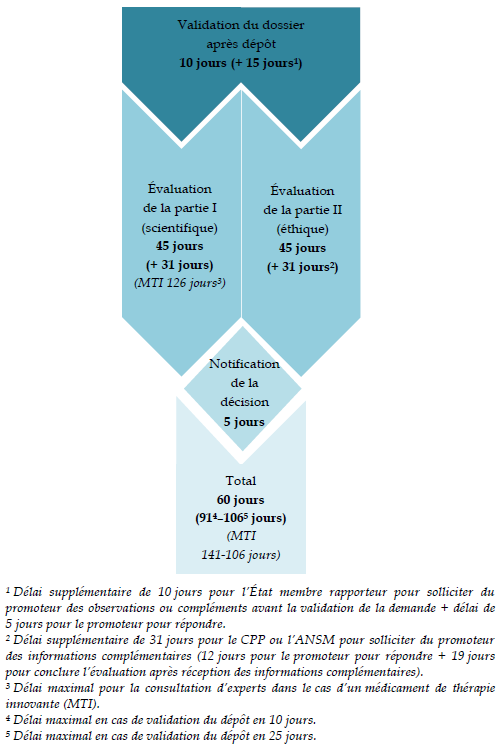
Les délais d'examen par les CPP précisés par le décret n° 2016-1537 du 16 novembre 2016 sont alignés sur ceux prévus par la réglementation européenne : le CPP est censé rendre son avis au plus tard 45 jours 34 ( * ) après notification au demandeur par la Cnriph de la réception du dossier complet.
Le code de la santé publique étend ce délai à 60 jours dans l'hypothèse d'une demande d'informations complémentaires formulée par le CPP, soit un délai plus exigeant que les 31 jours supplémentaires maximaux autorisés par le règlement européen dans le cas des essais cliniques de médicaments.
Les délais d'examen des demandes
d'autorisation
d'essai clinique de médicaments prévus par
le règlement (UE) n° 536/2014
Source : D'après l'ANSM (Laurence FLUCKIGER, réunion d'information du 29 juin 2015 ; http://ansm.sante.fr/var/ansm_site/storage/original/application/2613b6f060f27c8a5c4dbd7ee73dcc6e.pdf )
Plusieurs enquêtes ont été menées afin d'évaluer les effets du tirage au sort sur les délais d'examen des dossiers de recherche par les CPP :
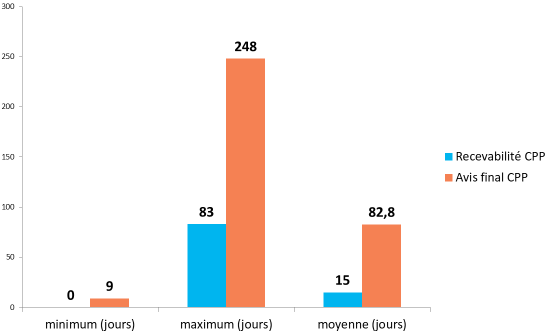
- l'enquête 35 ( * ) conduite en juin 2018 par la DGS, avec l'appui de la conférence nationale des comités de protection des personnes (CNCP), conclut à un délai moyen de 85 jours mais suggère que la responsabilité de ce retard est partagée entre CPP et promoteurs :
|
Phase |
Délai
|
Délai
|
Délai
|
Fréquence
|
|
A.
36
(
*
)
Entre le tirage au sort
|
16 jours |
0 jour |
82 jours |
18 % |
|
B.
37
(
*
)
Entre la recevabilité
|
28 jours |
4 jours |
81 jours |
14 % |
|
C.
38
(
*
)
Entre les questions du CPP
|
30 jours |
1 jour |
271 jours |
71 % |
|
D.
39
(
*
)
Entre la réponse du promoteur
|
11 jours |
1 jour |
63 jours |
20 % |
Source : Direction générale de la santé du ministère de la santé
- les résultats de la phase pilote dans laquelle la France s'est engagée afin de préparer l'entrée en vigueur du règlement européen 40 ( * ) montrent, au 31 mai 2018, une dégradation des délais moyens combinant l'examen par l'ANSM, l'examen par le CPP et la notification de l'avis favorable : de 57,4 jours à partir d'un bilan à six mois, le délai moyen pour le rendu de l'avis est passé à 71,5 jours sur 32 mois. L'ANSM indiquant avoir réduit son délai d'autorisation des essais cliniques de médicaments à 51 jours en juin 2018, les lenteurs peuvent être attribuées à la phase d'évaluation par les CPP ;
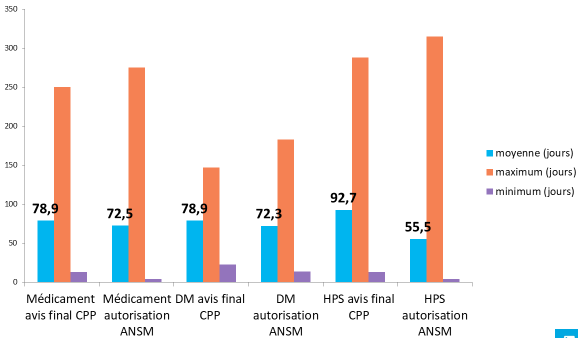
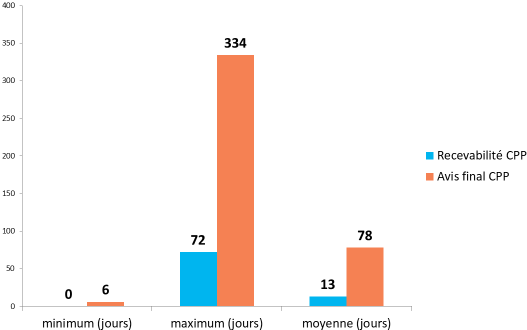
- l'enquête réalisée par la coordination des promoteurs institutionnels (CPI), publiée le 31 janvier 2018 et portant sur 839 essais 41 ( * ) conclut à un délai moyen de 83 jours pour les recherches de catégorie I, de 82 jours pour les recherches de catégorie II et de 78 jours pour les recherches de catégorie III :
|
Recherches de catégorie I |
Recherches de catégorie II |
Recherches de catégorie III |
|
DM : dispositif médical HPS : hors produits de santé |
Source : Coordination des promoteurs institutionnels
Depuis la mise en oeuvre du tirage au sort, le délai moyen d'examen par les CPP semble donc osciller entre 70 et 85 jours, au-delà du délai maximal inscrit dans la réglementation française (60 jours). Il est à noter cependant que, selon l'enquête précitée conduite par la DGS et la CNCP, le délai moyen de réponse par les promoteurs est de 30 jours alors que le règlement européen ne leur accorde que 12 jours.
De nombreux CPP ont indiqué pâtir de la charge de travail résultant de l'augmentation sensible du nombre de dossiers de recherche non interventionnelle. Bien que les projets de recherche de catégories II et III 42 ( * ) soient censés être examinés au sein d'un comité restreint 43 ( * ) , les CPP ont expliqué ne pas être enclins à mettre en oeuvre cette procédure allégée 44 ( * ) principalement pour trois raisons :
- une analyse qui se cantonnerait à l'appréciation du niveau de dangerosité de l'étude pour le patient est un exercice délicat et peu compatible avec l'évaluation éthique de dossiers qui pour beaucoup restent complexes 45 ( * ) et exigent un examen méthodologique en complément de l'analyse du seul plan d'information et de consentement. À cet égard, l'examen en comité plénier demeure une garantie d'évaluation éthique sérieuse ;
- l a qualité de certains dossiers pâtit du manque d'expérience et de formation de jeunes investigateurs, notamment des étudiants en médecine peu rompus à cet exercice, ou d'entreprises, notamment des start-ups , non épaulées par des structures d'accompagnement ;
- la disponibilité et les contraintes des membres des CPP se prêtent peu à l'organisation de réunions en comité restreint même par téléphone ou vidéoconférence, en dehors des séances plénières.
B. UNE DÉSIGNATION ALÉATOIRE QUI NE S'OPÈRE PAS DANS DES CONDITIONS OPTIMALES
1. Une procédure qui ne tient pas compte de la charge de travail des CPP
L'ensemble des personnalités auditionnées par le rapporteur de votre commission, de même que l'analyse des rapports d'activité des CPP, ont mis en lumière les difficultés importantes de fonctionnement des comités.
Dans le cadre d'un tirage au sort « sans remise » 46 ( * ) , tous les CPP sont amenés à examiner peu ou prou le même nombre dossiers. Or nombre d'entre eux, en particulier ceux qui n'avaient pas l'habitude de traiter un flux continu de dossiers, ne sont pas encore parvenus à rehausser leur niveau d'activité, d'autant que leur champ d'évaluation a été élargi aux recherches de catégorie III. Face à une charge de travail intenable, certains CPP ont demandé à être retirés du tirage au sort faute de pouvoir tenir les délais réglementaires.
Les difficultés organisationnelles des CPP tiennent en grande partie à la faiblesse de leurs moyens administratifs et financiers. Le secrétariat de nombreux CPP n'est assuré, à l'heure actuelle, que par un seul équivalent temps plein (ETP). Or ce poste, qui va bien au-delà du secrétariat administratif, est stratégique dans la bonne marche du comité : après avoir vérifié la complétude et la catégorie du dossier, le secrétariat identifie, en accord avec le président, le membre du CPP qui pourrait être désigné rapporteur ou entreprend les démarches pour solliciter un expert extérieur si la spécialité concernée n'est pas représentée au sein du CPP.
L'absence de ce personnel, en cas de congé ou d'arrêt maladie, peut alors paralyser le fonctionnement du CPP, comme l'illustre la problématique de la période estivale. Tant la suspension du tirage au sort à l'été 2017 que son maintien à l'été 2018 sur un nombre restreint de comités et de façon tournante ont conduit à un encombrement des séances des CPP.
En outre, beaucoup de CPP dépendent, pour leurs moyens matériels, des structures hospitalières qui les accueillent. Celles-ci respectent inégalement leurs obligations d'accompagnement logistique des CPP.
2. L'hétérogénéité de l'accès à l'expertise entre CPP
Dans le système antérieur au tirage au sort, le promoteur soumettait généralement son projet au CPP qu'il avait identifié comme spécialiste du domaine concerné et avec lequel il avait l'habitude de dialoguer. Le promoteur disposait ainsi d'une marge de manoeuvre pour déposer son dossier auprès du CPP qui lui paraissait le plus pertinent et programmer son inscription à une prochaine séance. Dans le cas où la date proposée lui semblait éloignée, il avait la possibilité de solliciter un autre CPP.
Dans un rapport de janvier 2014 47 ( * ) , l'inspection générale des affaires sociales (IGAS) relevait qu'un certain nombre de CPP « revendiquent avoir acquis une « spécialisation » dans un domaine précis (phases 1, oncologie, pédiatrie, orphelins, biotechnologies, collections d'échantillons biologiques, dispositifs médicaux, etc.) et des promoteurs choisissent de fait leur investigateur principal pour qu'il se situe dans l'interrégion du CPP qui leur paraît le plus spécialisé. »
Dans la perspective de la mise en place du tirage au sort, ce rapport préconisait la mise à disposition et l'actualisation sur le système d'information d'une liste d'experts dans des domaines de recherche spécifiques que les CPP pourraient solliciter en tant que de besoin, en l'absence de membre spécialiste du sujet.
Toutefois, au cours de ses auditions, le rapporteur de votre commission a pris la mesure de la difficulté pour nombre de CPP de s'adjoindre le concours d'experts spécialistes du champ de recherche concerné. Celle-ci tient à la fois :
- au manque d'attractivité de la fonction de rapporteur au sein d'un CPP, indemnisée à hauteur de 67 euros brut 48 ( * ) , à l'absence de valorisation de ce type d'activité dans le parcours professionnel de l'intéressé et aux contraintes professionnelles des spécialistes qui doivent étudier les dossiers et rédiger leurs rapports en dehors de leur temps de travail ;
- à l'étroitesse du vivier de spécialistes dans des aires thérapeutiques qui connaissent une profonde complexification technologique.
Le renouvellement des CPP tous les trois ans peut accentuer ces difficultés en cas de départ de spécialistes « rares ». Les démarches de recrutement de membres comme d'experts externes, y compris des experts dits obligatoires et prévus par la réglementation pour certains types de recherche (pédiatrie, majeurs protégés, phase 1, radioprotection et PMA) 49 ( * ) , s'apparentent, pour certains comités, à un véritable parcours du combattant et ralentissent l'examen des dossiers.
Lorsque ces difficultés de recrutement sont conjuguées à l'encombrement des séances, le CPP concerné se retrouve dans une impasse. Le SI RIPH ne permet pas au CPP, une fois désigné par tirage au sort, de se dessaisir d'un dossier. À l'heure actuelle, le silence gardé par le CPP au-delà du délai réglementaire vaut rejet. Or, à compter de l'entrée en vigueur du règlement européen relatif aux essais cliniques de médicaments, ce silence vaudra accord. Il est néanmoins peu probable que des promoteurs s'engagent dans le lancement d'un essai clinique dans un pays qui n'aurait pas rendu un avis éthique favorable explicite. Le silence d'un CPP au-delà du délai réglementaire pourrait alors disqualifier la France.
III. LA MODULATION DU TIRAGE AU SORT SELON LA DISPONIBILITÉ ET LA COMPÉTENCE DES COMITÉS DE PROTECTION DES PERSONNES
A. LES OBJECTIFS POURSUIVIS PAR LA PROPOSITION DE LOI
Ses auteurs estimant que « la composition des CPP, variable d'un territoire à l'autre, ne permet pas toujours de garantir l'expertise nécessaire à l'évaluation des projets de recherche », la proposition de loi visait initialement à s'assurer que le tirage au sort s'effectue « parmi les comités incluant un ou des membres dont l'expertise est nécessaire » pour l'examen du projet de recherche concerné.
Dans sa rédaction issue des travaux de l'Assemblée nationale en première lecture, la proposition de loi a été modifiée afin de prévoir que le tirage au sort tienne compte pour l'attribution d'un dossier de recherche :
- de la disponibilité des CPP, qui permettrait d'objectiver la capacité du comité à traiter le dossier dans le respect des délais réglementaires en fonction de sa charge de travail ;
- de la compétence des CPP, qui permettrait de confier l'examen du dossier à un CPP en mesure de mobiliser, en interne ou en externe, un spécialiste pertinent pour l'analyse du projet concerné.
B. LA POSITION DE LA COMMISSION DES AFFAIRES SOCIALES
Votre commission est convaincue de la pertinence de la désignation aléatoire des CPP. Des auditions conduites par son rapporteur, il ressort que cette désignation aléatoire a permis de réduire mécaniquement les risques de proximité entre le promoteur d'un projet de recherche et le CPP saisi de son évaluation éthique. Tant les représentants des CPP, des promoteurs industriels, institutionnels et académiques que des usagers du système de santé restent attachés à la vocation pluridisciplinaire des CPP qui fonde le sérieux et l'indépendance de l'évaluation éthique dans notre pays.
Le tirage au sort constitue un élément de prévention des conflits d'intérêts dans le système français de recherche clinique, en complément d'autres moyens :
- les membres et experts externes du CPP sont tenus aux obligations de déclaration publique de leurs liens d'intérêt et ne peuvent prendre part aux travaux, aux délibérations et aux votes du comité lorsqu'ils ont un intérêt, direct ou indirect 50 ( * ) , au dossier examiné ;
- le fonctionnement collégial des CPP et la complémentarité des collèges « scientifique » et « société civile » participent de l'indépendance des avis.
Consciente des difficultés rencontrées par les CPP pour respecter les délais réglementaires, votre commission considère néanmoins qu'une modulation de la procédure de tirage au sort selon la disponibilité et la compétence des comités est de nature, au moins à titre transitoire, à fluidifier le traitement des dossiers de recherche. L'imminence de l'entrée en vigueur du règlement européen relatif aux essais cliniques de médicaments représente un défi considérable pour le système d'évaluation scientifique et éthique français, dans un environnement européen et international fortement concurrentiel. Dans la mesure où le dépassement du délai réglementaire vaudra désormais acceptation et non plus rejet, il est inconcevable que des projets de recherche puissent être entrepris en l'absence de décision explicite quant à leur caractère éthique.
Dans son rapport d'information de juin 2018 sur l'accès précoce aux médicaments innovants 51 ( * ) , votre commission avait convenu de la nécessité d'adapter le système du tirage au sort « afin que celui-ci s'applique à un groupe restreint de CPP spécialisés en fonction du domaine de l'essai clinique. » Ce rapport avait préconisé, par ailleurs, le renforcement du niveau d'expertise des CPP, « notamment par la mise en place de formations adaptées et l'accès à des experts rapidement mobilisables », le cas échéant par l'intensification des « interactions avec l'ANSM dans le sens d'une mutualisation de l'expertise. » Il avait recommandé, enfin, l'harmonisation des procédures d'évaluation sous l'égide de la Cnriph.
Votre commission identifie, toutefois, plusieurs conditions que le Gouvernement devra respecter dans la mise en oeuvre de cette modulation afin que le tirage au sort conserve son sens.
1. La détermination de la disponibilité des CPP
Plusieurs éléments devront être pris en compte dans le SI RIPH afin d'objectiver la disponibilité des CPP au moment de la saisie par le promoteur de son dossier.
• La présence du personnel permanent :
La bonne instruction du dossier et la notification de l'avis reposent sur le secrétariat du comité. Si la continuité de ces étapes n'est pas assurée, le CPP concerné ne peut raisonnablement participer au tirage au sort.
• Le nombre de dossiers en cours et le calendrier des sessions :
Un rapport 52 ( * ) de l'Igas préconisait, en 2005, un maximum de cinq dossiers initiaux (hors modifications substantielles) par séance afin de permettre un temps de réflexion et de débat suffisant au sein du CPP et de tenir compte de la disponibilité des membres qui exercent généralement une activité professionnelle et participent au comité à titre bénévole. Au vu de l'ampleur des dossiers traités par les CPP depuis l'élargissement de leur champ d'évaluation aux recherches non interventionnelles, la DGS propose qu'un CPP soit considéré disponible tant qu'il n'aura pas traité au moins dix dossiers par mois. Votre commission insiste cependant sur la nécessité de définir ce seuil en concertation étroite avec les CPP, de sorte qu'il soit tenu compte de la situation de certains comités qui n'ont pas, à l'heure actuelle, la capacité d'absorber l'examen de dix dossiers par mois. Les dossiers doivent également pouvoir être orientés vers les comités présentant une séance programmée dans un délai raisonnable, évalué par la Cnriph entre 21 et 31 jours suivant le tirage au sort. Le SI RIPH devra donc intégrer le calcul du taux de remplissage des sessions de chaque comité.
Votre commission recommande également de tenir compte de la répartition des dossiers par catégorie de recherche et d'inviter les CPP à se saisir des réunions en comité restreint pour l'examen des recherches de catégories II et III.
2. La détermination de la compétence des CPP
Mesurant le risque d'une dénaturation du tirage au sort par une spécialisation des CPP, notre collègue député Cyrille Isaac-Sibille, dans son rapport 53 ( * ) au nom de la commission des affaires sociales de l'Assemblée nationale, plaide « pour une application mesurée de cette mesure qui pourrait être circonscrite aux spécialistes mentionnés à l'article R. 1123-14 du code de la santé publique (pédiatre et personnalité qualifiée en cas de recherche impliquant des personnes majeures hors d'état d'exprimer leur consentement) et aux deux experts mentionnés à l'article R. 1123-13 (rayonnements ionisants et première administration à l'homme des médicaments). »
Il considère néanmoins que la formulation retenue par la commission offre suffisamment de flexibilité pour permettre, dans un second temps, au Gouvernement d'ajuster le dispositif afin de tenir compte des besoins en expertise de certains CPP ou des changements de représentation des spécialités en leur sein au gré de leurs renouvellements triennaux.
Votre commission préconise la mise en oeuvre d'une modulation du tirage au sort selon la compétence la plus souple possible. Compte tenu de l'évolution et de la complexification des spécialités thérapeutiques, elle recommande de laisser à chaque CPP le soin de communiquer à la Cnriph les aires thérapeutiques pour lesquelles il s'estime à court et moyen termes dans l'incapacité de mobiliser un spécialiste. Plutôt que de limiter cette déclaration d'« incompétence » à des domaines prédéterminés par la DGS, il est préférable de s'en tenir aux spécialités identifiées par les CPP eux-mêmes qui savent apprécier les ressources de leur réseau d'experts disponibles 54 ( * ) .
La situation des CPP au regard de leur compétence doit demeurer réversible. Votre commission insiste sur la nécessité de permettre aux CPP de modifier à tout moment les disciplines entrant dans leur champ de compétence, en cas de modification de leur composition ou de nouveaux experts disponibles.
3. Les mesures d'accompagnement des CPP dans leur montée en charge
Votre commission estime que cette proposition de loi permettra de répondre à des difficultés ponctuelles et transitoires mais que l'objectif, à terme, reste que plus aucun CPP n'ait à se déclarer incompétent sur une spécialité. Dans cette optique, plusieurs mesures doivent être rapidement déployées par le Gouvernement :
- les moyens de la Cnriph doivent être significativement renforcés afin de lui permettre d'exercer ses missions dans :
• l'harmonisation des procédures d'évaluation entre CPP et l'émergence d'une culture commune dans le traitement des différentes catégories de recherche, en particulier en matière de recherche observationnelle, par la diffusion de bonnes pratiques et de référentiels d'évaluation. À cet effet, la création d'un site pour la Cnriph, qui n'existe toujours pas, s'impose ;
• la formation des membres des CPP et de leur personnel permanent, en vue de la professionnalisation de l'évaluation éthique. Les formations doivent, selon votre commission, mettre l'accent sur les enjeux de l'évaluation éthique de l'exploitation des données personnelles de santé, à l'heure où une concurrence intense s'annonce dans le développement d'études mêlant numérique et santé, alimenté par l'essor de l'intelligence artificielle.
Forte de bases de données cliniques puissantes, la France dispose d'un avantage comparatif en Europe mais d'autres pays, tels que les Pays-Bas et le Danemark 55 ( * ) , ont mis en place des plateformes susceptibles d'intéresser fortement les promoteurs de recherches observationnelles ;
• le développement, en partenariat avec les promoteurs, de tutoriels consultables en ligne permettant aux promoteurs d'être accompagnés dans le montage d'un dossier en fonction de la catégorie de la recherche. À cet égard, votre commission invite le Gouvernement à publier dans les meilleurs délais l'arrêté définissant le résumé du protocole des recherches non interventionnelles reposant sur des questionnaires ou entretiens ;
• l'établissement d'un réseau national d'experts dans différents domaines de la recherche clinique qui permettrait aux CPP de mobiliser des spécialistes non représentés en leur sein et dont la participation aux réunions et séances serait facilitée par le recours au téléphone ou à la vidéoconférence. Un réseau doit également être développé au niveau de chaque interrégion afin de faciliter le recrutement de membres au titre du collège « société civile », les CPP rencontrant également des difficultés à mobiliser des représentants d'usagers, des infirmiers ou encore des travailleurs sociaux ;
- la coordination entre les CPP et l'ANSM doit être renforcée, la plupart des pays européens multipliant les efforts en ce sens. À l'heure actuelle, l'ANSM n'est pas informée du CPP désigné pour l'examen d'un essai clinique. Or l'ANSM sera bientôt la seule entité à informer le promoteur de la décision finale concernant un essai clinique de médicament, ce qui rend une évaluation coordonnée par l'agence et le CPP incontournable. Certains CPP trouvent également un intérêt à interroger l'ANSM sur certains aspects méthodologiques afin d'apprécier le caractère éthique d'un projet. À cet effet, votre commission estime que l'inclusion de l'ANSM dans le SI RIPH est indispensable ;
- la participation aux activités des CPP doit être valorisée dans les parcours professionnels de leurs secrétaires, de leurs membres et de leurs experts. Votre commission recommande, par exemple, la prise en compte de la participation de médecins à des expertises pour le compte de CPP dans l'accès à des carrières universitaires, notamment aux postes de professeur des universités-praticien hospitalier (PU-PH).
Lors de l'examen en séance publique de la présente proposition de loi à l'Assemblée nationale, la ministre des solidarités et de la santé s'est engagée à ce que des moyens supplémentaires soient alloués aux CPP pour le renforcement de leurs personnels permanents. La DGS a ainsi indiqué que les CPP devraient, à l'avenir, disposer d'1,5 ETP.
Votre commission souligne la nécessité de pourvoir ces renforts administratifs par des personnes formées à l'instruction de dossiers de recherche clinique. À cet égard, l'élaboration par la Cnriph d'une fiche de poste de responsable du secrétariat d'un CPP, déclinant les compétences requises, constitue une avancée.
EXAMEN DE L'ARTICLE UNIQUE
___________
Article unique
(art. L. 1123-6 du code de
la santé publique)
Modalités du tirage au sort des
comités de protection des personnes
Objet : Cet article prévoit que la désignation aléatoire des comités de protection des personnes pour l'examen d'un projet de recherche impliquant la personne humaine s'effectue parmi les comités disponibles et disposant de la compétence nécessaire à l'examen du projet.
I. Le dispositif adopté par l'Assemblée nationale
Dans sa rédaction initiale, la proposition de loi entendait circonscrire le tirage au sort des CPP sur un projet de recherche à ceux qui comprenaient, en leur sein, un ou plusieurs membres disposant de l'expertise nécessaire à l'examen du projet. Le critère de disponibilité n'était, quant à lui, pas envisagé par les auteurs du texte.
Dans le texte qu'elle a établi sur cette proposition de loi, la commission des affaires sociales de l'Assemblée nationale a précisé, à la faveur d'un amendement du groupe La République en marche, que le tirage au sort doit s'opérer parmi les comités disponibles. Les CPP confrontés à l'impossibilité de rendre leur avis dans les délais en raison d'un nombre de dossiers en cours déjà important ou de l'absence de leur secrétariat permanent pourraient ainsi être retirés du tirage au sort.
En outre, la commission des affaires sociales de l'Assemblée nationale a substitué à la notion d'expertise celle de compétence. En effet, dans la partie réglementaire du code de la santé publique, il est fait usage des termes d'« expert », de « spécialiste » et de « personne qualifiée » pour désigner les personnes dont le CPP doit s'adjoindre le concours pour certains types de projet de recherche (pédiatrie, majeurs protégés, phase 1, radioprotection, PMA) ou peut mobiliser en fonction de ses besoins et du sujet concerné. En tendant à ce que le tirage au sort s'opère parmi les comités disposant de la compétence nécessaire, c'est la capacité du CPP à mobiliser, en interne comme en externe, des spécialistes pertinents qui sera prise en compte.
Par coordination, la commission des affaires sociales a modifié l'intitulé de la proposition de loi afin d'y remplacer le terme d'« expertise » par ceux de « désignation aléatoire ».
L'examen en séance publique à l'Assemblée nationale n'a pas modifié l'économie du texte et seul un amendement rédactionnel a été adopté.
II. La position de la commission
Soucieuse de permettre rapidement la réalisation des objectifs de réduction des délais d'autorisation des essais cliniques fixés par le 8 e Csis, votre commission est favorable à l'adoption de la présente proposition de loi. La prise en compte de la charge de travail des CPP et de leur capacité à mobiliser les spécialistes les mieux à même d'éclairer le CPP est en effet de nature à faciliter le fonctionnement des comités.
Toutefois, les conditions de mise en oeuvre de cette modulation du tirage au sort méritent d'être précisées afin de préserver la vocation pluridisciplinaire des CPP qui constitue le fondement d'une évaluation éthique indépendante et sérieuse, gage de sécurité pour les patients et de légitimité pour les promoteurs :
- votre commission plaide pour que le critère de la compétence soit apprécié souverainement par le CPP. Le principe d'une déclaration d'« incompétence » par le CPP sur une spécialité pour laquelle les difficultés de recrutement lui semblent dirimantes devrait être préféré à un classement par le ministère de la santé des CPP compétents par aires thérapeutiques ;
- le fait pour un CPP de se déclarer incompétent sur une spécialité ne devrait constituer qu'un état transitoire et réversible. La vocation pluridisciplinaire des CPP exige que les moyens humains, matériels et financiers suffisants leur soient consentis afin qu'ils puissent, à terme, être tous en capacité d'examiner des projets de recherche dans tous les champs de la recherche biomédicale.
Si ces conditions n'étaient pas remplies, l'identification des CPP en fonction de leur compétence pourrait conduire à une spécialisation définitive qui ne ferait que reproduire les déséquilibres observés dans le système antérieur au tirage au sort. La concentration de l'examen de projets de recherche sur un petit nombre de CPP dans un champ thérapeutique donné accentuerait le risque de dépassement des délais, soit un effet inverse à l'objectif poursuivi par la proposition de loi. Elle renforcerait également les inégalités entre CPP en réservant à certains les avis sur des matières identifiées comme « nobles » et en les délestant de projets perçus comme plus secondaires. S'ensuivrait un effet de démotivation dévastateur sur nombre de CPP et remettrait en cause l'existence même d'un tissu national de CPP.
Au bénéfice de ces observations, votre commission a adopté l'article unique sans modification.
EXAMEN EN COMMISSION
___________
Réunie le mardi 25 septembre 2018 sous la présidence de M. Alain Milon, président, la commission des affaires sociales procède à l'examen, selon la procédure de législation en commission (articles 47 ter à 47 quinquies du Règlement), du rapport de M. Jean Sol sur la proposition de loi n° 489 (2017-2018), adoptée par l'Assemblée nationale, relative à la désignation aléatoire des comités de protection des personnes.
M. Alain Milon , président . - Nous examinons cet après-midi la proposition de loi, adoptée par l'Assemblée nationale le 17 mai 2018, relative à la désignation aléatoire des comités de protection des personnes.
Il s'agit d'un texte court, mais dont les enjeux ont été à l'origine de longs débats entre les deux assemblées dans le cadre de l'examen de la loi relative aux recherches impliquant la personne humaine, dite « loi Jardé », en vue de trouver un équilibre entre le développement de la recherche et la garantie de l'examen éthique des projets.
Ainsi qu'il a été décidé par la conférence des présidents, avec l'accord de tous les présidents de groupe, nous légiférons selon la procédure de législation en commission prévue aux articles 47 ter et suivants du règlement du Sénat. Le droit d'amendement des sénateurs et du Gouvernement s'exerce donc uniquement en commission. Notre réunion est publique, avec une retransmission sur le site du Sénat et elle se tient en présence du Gouvernement. Je salue donc la présence de Mme Agnès Buzyn, ministre des solidarités et de la santé.
Mme Agnès Buzyn, ministre des solidarités et de la santé. - La proposition de loi qui vous est soumise aujourd'hui vise à renforcer l'attractivité de la France en termes de recherche clinique, notamment en renforçant l'efficacité du tirage au sort des comités de protection des personnes, les CPP. Je vous rappelle que tout promoteur de recherche impliquant la personne humaine doit se soumettre à cette procédure pour obtenir un avis éthique sur son projet.
Ce texte, auquel j'étais favorable à l'Assemblée nationale, contribue à l'une des priorités du Gouvernement : maintenir et renforcer l'attractivité de la France en matière de recherche impliquant la personne humaine, tout en assurant la sécurité des personnes qui s'y prêtent. En effet, aujourd'hui, la France figure parmi les trois pays européens les plus attractifs en matière de recherche clinique aux côtés de l'Allemagne et de la Grande-Bretagne, mais, depuis quelques années, elle accuse un retard qui augmente, concernant notamment les essais cliniques de phase 1. Nous devons rattraper ce retard, non seulement pour tenir notre place dans ce domaine, mais parce que nous pensons que nous pouvons être un leader mondial. Le fait d'être attractif pour les essais de phase 1 permet aux patients français d'accéder plus rapidement aux innovations, car il permet un accès accéléré aux médicaments innovants.
C'est la raison pour laquelle le Premier ministre a souhaité que le renforcement de l'attractivité de la recherche clinique française soit un des axes prioritaires du 8 e conseil stratégique des industries de santé (Csis). Nous nous sommes fixé un délai de cinq ans pour faire de nouveau de la France le premier pays européen en recherche clinique. Je cite le Premier ministre : « Ces dernières années, l'allongement des délais d'autorisation a entravé [l']essor [des essais cliniques] et tout le monde en pâtit : la recherche, les patients et l'industrie, ce n'est plus tenable. Nous voulons réduire drastiquement les délais en les abaissant, dès 2019, à 45 jours pour l'agence nationale de sécurité du médicament et à 60 jours pour les autorisations émanant des comités de protection des personnes. » Atteindre cet objectif suppose évidemment la mobilisation de tous les acteurs : d'une part, celle de l'agence nationale de sécurité du médicament (ANSM), qui a d'ores et déjà adapté son organisation en mettant notamment en place une phase pilote de fonctionnement selon les exigences du règlement européen relatif aux essais cliniques ; d'autre part, il faut que les promoteurs et, bien sûr, les CPP s'adaptent. Je tiens à souligner à ce propos que les membres des CPP, qui sont des bénévoles et mènent en parallèle leur carrière, réalisent leur mission, malgré toutes les difficultés rencontrées, avec un dévouement qu'il faut saluer.
Cette proposition de loi apporte une solution à un point de cristallisation de la mise en oeuvre, en novembre 2016, de la réforme de la loi Jardé. Il s'agit, vous le savez, du dispositif d'attribution purement aléatoire par un système d'information d'un dossier émanant d'un promoteur à un CPP. Cette proposition de loi permet de maintenir l'exigence de déontologie forte qui a été légitimement voulue lors de la mise en place de ce tirage au sort, c'est-à-dire s'assurer de l'absence de tout conflit d'intérêts. Il s'agit bien d'améliorer le tirage au sort, et non pas de le remettre en cause par un mécanisme qui reviendrait à une spécialisation des CPP, tout en répondant à la volonté des personnes malades et des professionnels de santé d'accéder dans les meilleurs délais aux traitements innovants.
Il est certain que le tirage au sort a eu pour conséquence un allongement du rendu des avis des CPP, notamment du fait de la complexité de la compréhension de certains médicaments ou dispositifs innovants. Il a aussi conduit à un changement brutal d'organisation de certains CPP qui ont du mal à faire face à un flux continu de dossiers, compte tenu des dates de réunion préalablement fixées. Il a aussi mis en évidence le fait que certains CPP ne disposent pas de compétences pour les sujets les plus complexes, je pense notamment aux essais pédiatriques. Ce manque de compétences les empêche de rendre un avis dans les délais réglementaires.
Le critère de disponibilité permettra donc de réguler plus finement l'attribution des dossiers et leur examen dans les délais prévus par la réglementation. En effet, les travaux de la Commission nationale des recherches impliquant la personne humaine (Cnriph) ont permis de montrer que le tirage au sort d'un CPP devait avoir lieu dans un délai compris entre le 21 e et le 30 e jour avant une séance du CPP, afin de permettre que le dossier soit examiné à la séance suivante. Dans le cas contraire, le délai nécessaire à l'instruction ne permettra pas au CPP d'étudier le dossier à la séance suivante, et donc de rendre son avis dans les délais réglementaires. Ce critère permettra aussi de prévoir un nombre de dossiers traités par les CPP afin d'éviter leur engorgement, de lisser leur activité dans le temps, et donc d'éviter un retard dans l'examen des dossiers.
Le critère de compétence permettra aussi de résoudre la question du défaut d'expertise de certains CPP, notamment pour l'examen de projets de recherche sur des thèmes très particuliers. La Cnriph a réalisé une enquête qui montre que certains CPP rencontrent des difficultés à recourir à certaines expertises, ce qui les conduit donc à rendre leur avis très au-delà des délais réglementaires.
Le critère de compétence permettra d'aider les CPP, compte tenu de leur composition et de leur capacité à recourir à l'expertise, à déclarer eux-mêmes, de façon transitoire, qu'ils ne sont pas en mesure d'évaluer un certain type de dossier. Soyons clairs : je souhaite que l'ensemble des CPP conserve une compétence générale pour donner un avis sur l'ensemble des dossiers de recherche. L'introduction des deux critères de disponibilité et de compétence ne ralentira pas les processus d'instruction, bien au contraire. Ces critères contribueront grandement à rendre efficient le tirage au sort ; ils sont à la fois nécessaires et suffisants pour répondre à l'enjeu, à savoir la diminution drastique des délais d'autorisation d'essais cliniques dont chaque acteur aujourd'hui pâtit, en premier lieu les patients.
Cette proposition de loi intervient alors même qu'un ensemble d'actions visant à l'amélioration du fonctionnement des CPP, piloté par la Cnriph et le ministère de la santé, est déjà engagé. En effet, la Cnriph travaille aussi à l'amélioration des conditions d'exercice des CPP. Elle a d'abord travaillé à la clarification de l'environnement réglementaire et à la qualification des recherches. Elle finalise actuellement une grille commune d'évaluation des dossiers. Elle a engagé un travail de formation des membres et des secrétaires. Une agence comptable unique, commune à l'ensemble des CPP, sera mise en place en janvier 2019, ce qui simplifiera le travail budgétaire et comptable des CPP.
Il convient enfin de rappeler que nos travaux s'inscrivent dans un cadre réglementaire européen en évolution. Les règlements européens portant sur les essais cliniques de médicaments à usage humain et les dispositifs médicaux de diagnostic in vitro entreront en vigueur, respectivement en 2020 et 2022. Dans le cadre de ces futurs règlements européens, un CPP qui ne répondrait pas dans les délais prévus rendrait, par défaut, un avis favorable. Cela serait très préjudiciable à la sécurité des personnes se prêtant volontairement aux essais cliniques. Il est donc indispensable de permettre aux CPP de rendre des avis de qualité dans les délais attendus. C'est ce que permet cette proposition de loi.
Je m'engage par ailleurs à mettre tout en oeuvre, d'un point de vue tant réglementaire qu'opérationnel, pour que cette proposition de loi puisse être applicable le plus rapidement possible. Comme vous le voyez, nos travaux ont le même objectif : renforcer la recherche clinique française au profit des malades, mais aussi de leur sécurité.
M. Jean Sol , rapporteur . - Les Français sont traditionnellement convaincus de l'intérêt de la recherche clinique, synonyme de prestige pour les établissements de santé et d'accélération de l'accès au progrès médical pour les patients. Selon une étude Ifop de 2010, les essais cliniques sont, pour plus de neuf Français sur dix, une garantie de fiabilité d'un médicament.
Pour autant, moins de la moitié de nos compatriotes se disent prêts à y participer. Le scandale du Mediator et l'affaire Biotrial sont, depuis, passés par là et n'ont pas contribué à lever les craintes. Derrière une apparente bienveillance, se cache donc encore une forme de méfiance chez nos concitoyens à l'égard des essais cliniques, dont il nous faut tenir compte, car, sans volontaires, il n'y a pas d'essais.
Réduire les délais d'autorisation des essais ne permettra pas à notre pays de retrouver son rang dans la recherche clinique mondiale si les conditions ne sont pas réunies pour rassurer des volontaires pour qui tous les risques ne sont pas bons à prendre. C'est précisément dans cet esprit que notre commission a été à l'origine de l'introduction, dans la loi Jardé de 2012, du tirage au sort des CPP pour l'évaluation éthique des projets de recherche.
Permettez-moi, tout d'abord, de saluer l'investissement des 39 CPP répartis sur notre territoire qui effectuent un travail formidable avec souvent des moyens indigents. Animés par des bénévoles du milieu médical et de la société civile, ils garantissent une évaluation éthique pluridisciplinaire et indépendante des projets de recherche.
Le tirage au sort, qui n'est effectif que depuis novembre 2016, a d'abord eu le mérite de rééquilibrer le nombre de dossiers attribués à chaque CPP. Ce lissage a nécessairement demandé à certains d'entre eux des efforts de réorganisation qui ont dû être menés, je le rappelle, à moyens constants et réclament encore du temps. Mécaniquement, le tirage au sort a également permis de réduire le risque de proximité entre promoteurs et membres des CPP.
Pour autant, le tirage au sort a mis en lumière des inégalités entre CPP, inégalités qui, j'insiste, préexistaient à ce mode de désignation. Face à la complexification des spécialités thérapeutiques et à la sophistication des protocoles de recherche, certains CPP, déjà confrontés à l'augmentation de leur charge de travail depuis l'élargissement de leur champ d'évaluation aux recherches non interventionnelles, se retrouvent démunis pour mobiliser un expert dans le domaine de recherche concerné.
Il semble que le délai moyen d'examen par les CPP oscille désormais entre 70 et 85 jours, soit un résultat bien supérieur à l'objectif de 60 jours fixé lors du dernier conseil stratégique des industries de santé. Dans ce contexte, nos collègues Catherine Deroche, Véronique Guillotin et Yves Daudigny, dans leur rapport d'information sur l'accès précoce aux médicaments innovants, ont appelé au pragmatisme : ils ont préconisé une modulation du tirage au sort selon la compétence, afin d'attribuer un dossier de recherche à un CPP capable de mobiliser des experts dans le domaine concerné, et avaient plaidé pour un renforcement du niveau d'expertise de tous les CPP par la mise en place de formations adaptées et d'un réseau d'experts rapidement mobilisables.
Je partage pleinement leurs recommandations qui conservent tout leur sens dans l'examen de cette proposition de loi. La concurrence internationale dans l'implantation des essais cliniques s'intensifie, à l'heure où l'Union européenne s'apprête à réduire les délais d'évaluation scientifique et éthique à partir de 2020 pour les médicaments et 2022 pour les dispositifs médicaux.
L'allongement des délais d'examen par les CPP pourrait alors peser sur le positionnement de notre pays dans la recherche clinique mondiale et représenter une perte de chance pour les patients dans l'accès aux thérapies innovantes.
La proposition de loi, dans sa rédaction issue des travaux de l'Assemblée nationale, vise à moduler le tirage au sort des CPP afin qu'il tienne compte, pour l'attribution d'un dossier de recherche, d'une part, de la disponibilité des CPP, qui permettrait d'objectiver la capacité du comité à traiter le dossier dans le respect des délais réglementaires en fonction de sa charge de travail et, d'autre part, de la compétence des CPP, qui permettrait de confier l'examen du dossier à un comité en mesure de mobiliser, en interne ou en externe, un spécialiste pertinent pour l'analyse du projet concerné.
La rédaction retenue par nos collègues députés me semble équilibrée et de nature à permettre une plus grande réactivité des CPP. Je rappelle que, à compter de l'entrée en vigueur du règlement européen sur les essais cliniques de médicaments, le dépassement du délai réglementaire vaudra désormais accord et non plus rejet. Il est donc inconcevable que des projets de recherche puissent être entrepris en l'absence de décision explicite quant à leur caractère éthique, au motif que le CPP concerné aurait gardé le silence.
Toutefois, les conditions de mise en oeuvre de cette modulation du tirage au sort méritent, à mon sens, d'être précisées afin de préserver la vocation pluridisciplinaire des CPP qui constitue le fondement d'une évaluation éthique indépendante et sérieuse.
D'une part, je plaide pour que le critère de la compétence soit apprécié souverainement par le CPP, qui devrait pouvoir identifier lui-même les spécialités pour lesquelles les difficultés de recrutement lui semblent discriminantes. Si certains CPP ne sont pas encore aujourd'hui en capacité de mobiliser des experts en oncohématologie, domaine faisant l'objet d'un grand nombre d'essais cliniques, d'autres rencontrent de véritables difficultés à s'adjoindre le concours de pédiatres ou d'ophtalmologues.
D'autre part, il est primordial, à mon sens, que le fait, pour un CPP, de se déclarer incompétent sur une spécialité ne soit qu'un état transitoire et réversible. La vocation pluridisciplinaire des CPP exige que les moyens humains, matériels et financiers suffisants leur soient consentis afin qu'ils puissent, à terme, être tous en capacité d'examiner des projets de recherche dans tous les champs de la recherche biomédicale.
À cet égard, je salue l'engagement pris par Mme la ministre, devant l'Assemblée nationale, de renforcer les moyens des secrétariats permanents des CPP. Mais il me semble indispensable d'aller beaucoup plus loin.
La Cnriph doit enfin avoir les moyens de remplir ses missions, ce qui est loin d'être le cas. L'harmonisation des procédures d'évaluation entre CPP, la formation de leurs membres et de leur secrétariat, la mise en place d'un réseau national d'experts rapidement mobilisables et le développement de tutoriels à l'intention des promoteurs pour le montage des dossiers sont autant d'actions essentielles pour le maintien d'une évaluation éthique crédible dans notre pays.
À mon sens, cette proposition de loi apporte une solution pragmatique à des difficultés qui doivent demeurer transitoires. À terme, l'objectif est bien que plus aucun CPP n'ait à se déclarer incompétent sur une spécialité. À défaut, une spécialisation définitive des CPP ne ferait que reproduire les déséquilibres observés dans le système antérieur au tirage au sort. La concentration de l'examen de projets de recherche sur un petit nombre de CPP dans un champ thérapeutique donné accentuerait le risque de dépassement des délais, soit un effet inverse à l'objectif de la proposition de loi.
Au bénéfice de ces observations, j'invite donc la commission à adopter ce texte sans modification.
M. Bernard Jomier . - Il y a consensus sur le constat - exprimé notamment dans le rapport établi par nos collègues Yves Daudigny, Catherine Deroche et Véronique Guillotin - du caractère non satisfaisant d'une procédure qui contribue à allonger les délais des essais cliniques. Ce constat appelle une réponse.
Les CCP font face à des difficultés que nous connaissons bien, d'abord parce que la loi Jardé a ajouté une troisième catégorie de recherches pour lesquelles leur avis est nécessaire. Des CPP qui, avant la réforme, étudiaient trois ou quatre dossiers par mois se retrouvent maintenant à étudier une dizaine de dossiers par mois, même s'il existe une procédure allégée pour les dossiers estimés sans risque.
Ensuite, les membres qui y siègent sont bénévoles et ils doivent souvent prendre une journée par mois pour venir étudier les dossiers. Chaque CPP dispose d'un seul équivalent temps plein (ETP) pour son secrétariat, c'est très pratique, mais, compte tenu des congés, il y a des périodes sans secrétariat, où la procédure peut prendre du retard.
Par ailleurs, tous les CPP n'ont pas tous les spécialistes nécessaires : par exemple, seulement la moitié des 39 CPP ont un pédiatre et 8 un spécialiste des rayonnements ionisants. Donc, ces CPP doivent chercher un expert dans leur réseau, demander des informations complémentaires aux promoteurs, etc., ce qui rallonge encore la procédure. Ainsi, des dossiers qui sont envoyés à des CPP ne peuvent pas être réceptionnés, faute de temps de secrétariat disponible ou parce que le plan de charge ne permet pas l'examen en temps voulu. De ce fait, une proportion importante - un tiers à la moitié - des dossiers ne serait pas traitée dans le délai imparti.
Pour autant, le dispositif législatif en question est récent, puisque les décrets ont été pris en 2016 - voire mai 2017, pour le plus important. Quant à l'opérationnalité, elle n'a été complète qu'au début de 2018, puisque le système d'information de la Cnriph qui permet, au niveau national, les échanges entre les promoteurs et les CCP, ainsi qu'entre les CCP et l'ANSM, n'est opérationnel que depuis le début de cette année. Or nous voulons modifier aujourd'hui ce dispositif. Avons-nous bien le recul nécessaire ?
Vous avez cité les pistes d'amélioration consistant à augmenter les moyens de fonctionnement dévolus aux CCP. Je salue les propos que vous avez tenus lors du débat à l'Assemblée nationale sur cette question, madame la ministre. C'est important, parce que la dotation de l'État aux CPP a baissé : elle a été fixée initialement à 3,5 millions d'euros, elle est passée à 3,3 millions d'euros, ce qui a accru les difficultés de fonctionnement des CCP. Mais ce n'est pas une question d'ordre législatif.
Travailler sur la reconnaissance des parcours des membres des CPP, ainsi que l'a proposé le rapporteur à l'Assemblée nationale, afin de valoriser le temps consacré à cette activité bénévole, n'est pas non plus une réponse relevant du domaine législatif.
La création d'une liste nationale d'experts pour faciliter le travail des CPP a été évoquée, mais cette liste était déjà prévue par la loi Jardé. Or elle n'existe toujours pas. Quels problèmes pose donc la constitution de cette liste qui permettrait d'apporter une réponse convenable au problème des CPP sans avoir à changer la loi ? Pourquoi les CPP qui ne disposent pas des ressources suffisantes en termes d'expertise n'ont-ils pas, plusieurs années après le vote de la loi, accès à cette liste nationale qui était prévue par la loi ?
En résumé, les améliorations nécessaires relèvent largement du domaine réglementaire. D'ailleurs, la proposition de loi, telle qu'elle est rédigée, modifie l'article L. 1123-6 du code de la santé publique, mais renvoie à un décret en Conseil d'État les précisions sur la procédure. En quoi cette proposition de loi est-elle donc nécessaire ? Notre rapporteur lui-même vient de souligner que des précisions doivent être apportées, notamment pour éviter que la qualité pluridisciplinaire des CPP ne soit altérée. Il faudra bien un texte d'application en aval de l'adoption de cette proposition de loi pour préciser la sécurisation du principe de désignation aléatoire et de pluridisciplinarité. J'ai bien entendu, madame la ministre, votre volonté d'éviter la constitution de clusters de CPP spécialisés qui paraît contradictoire avec la lutte contre les conflits d'intérêts. Je constate que nous manquons d'informations à ce sujet et qu'une étude d'impact aurait été bienvenue.
Enfin, vous l'avez rappelé, un règlement européen sur les essais cliniques de médicaments, voté en 2014, mais toujours pas entré en vigueur, prévoit la création, au niveau européen, d'un portail unique et d'une base de données. Il doit entrer en vigueur six mois après la publication attestant du bon fonctionnement des outils informatiques prévue courant 2019 - Mme la ministre nous a indiqué que ce serait plutôt en 2020. Il concerne toutes les recherches interventionnelles nationales et multinationales sur les médicaments, y compris les thérapies innovantes, mais ne couvre pas toutes les recherches relevant de la loi Jardé. S'agissant d'un règlement, une transposition en droit français n'est pas nécessaire, un simple toilettage du code de la santé publique suffira. Ce règlement a pour objectif de faire tenir toute la procédure en 60 jours, dont 45 jours pour l'évaluation éthique. Les acteurs français se sont mobilisés, comme vous l'avez rappelé, pour se préparer à ce nouveau cadre, en collaboration avec les promoteurs privés comme académiques.
Une phase pilote de deux ans a été lancée au niveau national, simulant le mode de fonctionnement qu'instaurera le règlement européen. En septembre 2017, un bilan quantitatif assez positif a été établi : sur 260 dossiers déposés dans le cadre de cette expérimentation, 210 ont été gérés dans de bonnes conditions. La France a été la première à lancer cette phase pilote et les résultats montrent que la mobilisation est bien réelle et que les efforts qui sont essentiellement d'ordre organisationnel paient, sans avoir besoin de changer la loi. On peut légitimement juger que les préoccupations des promoteurs de projets de recherche sur les médicaments ont trouvé un écho à la Commission européenne et trouveront satisfaction avec l'entrée en vigueur prochaine du règlement européen.
Nous en sommes donc au stade où un dispositif législatif vient tout juste d'être complété et nous savons que, dans 12 ou 18 mois, un dispositif européen complet entrera en vigueur. Est-il nécessaire, dans cet intervalle, de revenir sur la loi, alors que des dispositions d'ordre réglementaire suffiraient à améliorer le dispositif ? À défaut de réponses satisfaisantes sur ce point, il nous sera difficile de voter en faveur de cette proposition de loi, mais nous attendons vos éléments de réponse.
M. Michel Amiel . - L'objectif de la proposition de loi est l'amélioration des essais cliniques et le renforcement de la compétitivité de notre industrie pharmaceutique, sujet non négligeable, mais trois autres points méritent d'être abordés.
Tout d'abord, la constitution d'une liste d'experts paraît nécessaire. Le nombre et la diversité des spécialistes doivent être suffisants pour maintenir le pool de CPP à 39, en particulier dans certaines spécialités comme la pédiatrie.
Ensuite, les moyens alloués au niveau administratif ne permettent l'emploi que d'un ETP, au risque de limiter l'efficacité des CPP.
Enfin, rappelons que la loi Jardé date de 2012 et que les décrets d'application ont été pris en 2016, voire 2017. Cela prouve que les choses n'étaient pas simples ! Une réduction trop importante du nombre des CPP concernés par le tirage au sort ne nuirait-elle pas à l'esprit de ce texte, lequel a pour but de limiter les conflits d'intérêts ?
M. Daniel Chasseing . - Cette proposition de loi vise à pallier les dysfonctionnements des CPP en précisant les modalités de leur désignation par tirage au sort, afin de permettre une évaluation plus adaptée des projets de recherche. Cette modification est motivée par le souci de réduire les délais de l'évaluation menée par le CPP tiré au sort. En effet, faute de disposer de compétences, ces comités sont souvent incapables de rendre un avis dans le délai imposé de 45 jours, un silence entraînant un rejet de la demande.
Une telle issue est insatisfaisante. Le promoteur peut, certes, demander au ministère de soumettre le projet à un second examen, mais sans garantie de compétence dans la spécialité concernée. Ce dysfonctionnement pénalise la réalisation d'essais cliniques sur le territoire français, ce qui a des conséquences négatives pour les malades, la recherche en santé, l'innovation, l'économie et l'emploi.
Cette loi permettra de rendre des avis dans les délais prévus, au profit des malades et de l'attractivité de notre pays dans le domaine de la recherche clinique. J'y suis donc favorable.
Mme Laurence Cohen . - Cette proposition de loi est une fausse bonne idée. La fin du tirage au sort risque de soumettre des CPP en nombre réduit aux pressions des grands groupes pharmaceutiques. Les comités chargés d'examiner les conditions des essais cliniques seront en effet connus à l'avance, ce qui est contraire aux principes de neutralité et d'impartialité.
On nous dit que les CPP ne disposent pas toujours des experts compétents. Il s'agit en fait d'une question de moyens. Comment l'autorité que vous avez évoquée, madame la ministre, aura-t-elle les moyens humains et financiers de choisir le comité disposant de la bonne compétence ?
Il y a beaucoup d'inconnues ! Je suis sensible, avec mon groupe, aux problématiques de conflit d'intérêts, lesquelles ne me semblent pas réglées par le texte. Cela ouvre le débat sur le pôle public du médicament et de la recherche, lequel serait très utile par les temps qui courent.
Mme Agnès Buzyn, ministre . - Madame Cohen, il n'est pas question dans la proposition de loi d'une autorité, mais d'un système informatique auquel les CPP transmettront le nombre de dossiers qu'ils ont à traiter et le délai d'attente. Cela permettra d'éviter l'engorgement des comités et de connaître leurs compétences. Le système sera évolutif, car un CPP qui n'est pas compétent peut disposer d'un expert six mois plus tard.
La proposition de loi ne vise pas, loin de là, à limiter la transparence ou à favoriser les conflits d'intérêts. Pour avoir présidé l'Institut national du cancer, je puis vous dire qu'en France le nombre d'essais académiques, opérés par des promoteurs académiques testant non pas des médicaments à proprement parler, mais des stratégies de traitement, est bien supérieur à celui des essais industriels, ce qui est de nature à augmenter l'attractivité de la recherche clinique française, ainsi que le niveau et la rapidité des publications de nos scientifiques et cliniciens. Ce n'est donc pas un texte pour l'industrie pharmaceutique.
Monsieur Jomier , nous disposons bien du recul nécessaire puisque les premiers tirages au sort datent de novembre 2016. À cette occasion, les promoteurs nous ont fait part de retards significatifs dans les délais de réponse.
Il a été question d'une liste nationale d'experts, mais il ne me semble pas que cela soit dans l'esprit de la loi Jardé, laquelle prévoit une pluridisciplinarité, des regards croisés sur un sujet. Cette liste, qui a été proposée par la Cnriph, ne figure pas dans la loi. Cela reviendrait à dire que l'avis d'un seul expert suffirait. Or la compétence des CPP tient justement à l'expertise collective émise, à la fois, par une infirmière, un professeur de droit, un éthicien et un clinicien. Aller chercher un expert au coup par coup sur une liste est contraire à l'esprit même du CPP. Par ailleurs, il faudrait la tenir à jour, vérifier les conflits d'intérêts en permanence.
Pourquoi en passer par la loi ? Le principe du tirage au sort ayant été posé par la loi Jardé, toute modulation de ce processus relève du niveau législatif.
La proposition de loi ne sera modifiée en rien par le règlement européen, celui-ci ne traitant pas de la désignation des CPP.
La moyenne de traitement des dossiers est actuellement de 71 jours, soit 15 jours de plus que les délais légaux. Cela nous inquiète d'autant plus que le nombre de dossiers examinés par les CPP s'accroît. L'amélioration, via le système d'information, de l'efficience du tirage au sort permettra de résoudre ce problème. L'idée n'est pas de restreindre le nombre de CPP ayant une compétence donnée, mais d'en avoir suffisamment pour que le tirage au sort concerne une dizaine ou une quinzaine d'entre eux.
Outre la compétence des CPP, les délais seront également inscrits dans le système d'information, afin d'améliorer la fluidité du traitement des dossiers.
M. Jean Sol , rapporteur . - Monsieur Jomier , l'effectif du secrétariat des CPP passera de 1 à 1,5 ETP, afin que soit assurée la continuité du traitement des flux.
Le tirage au sort est opérationnel depuis novembre 2016. La Cnriph et la Conférence nationale des comités de protection des personnes (CNCP) ont admis que le recul était suffisant pour évaluer les problèmes organisationnels posés par ce mode de désignation.
S'agissant de la liste nationale d'experts, il est apparu qu'aucune solution n'était satisfaisante à elle seule. Compte tenu de la complexification des spécialités thérapeutiques et de l'étroitesse du vivier de spécialistes dans certaines aires thérapeutiques, le réseau national d'experts ne sera pas en mesure de combler systématiquement tous les besoins d'expertise.
Si le réseau ne comprend que deux experts en virologie déjà mobilisés dans l'examen des projets pour deux CPP, que faisons-nous pour les autres projets de recherche dans ce domaine qui restent à attribuer ? Faut-il inclure les CPP qui n'ont toujours pas d'accès à des virologues pour ces dossiers, au risque de les mettre en difficulté, ou circonscrire le tirage au sort aux CPP qui ont déjà accès à des virologues ? La deuxième option s'impose. Il est dans l'intérêt de l'évaluation de permettre cette modulation selon la compétence pour tenir compte ponctuellement des difficultés de recrutement des CPP, qui pourraient ne pas toujours être résolues par une liste nationale d'experts.
S'agissant de la phase pilote de l'ANSM, une enquête effectuée par des promoteurs institutionnels a conclu à un délai de 83 jours effectifs pour les recherches de catégorie 1, soit les essais cliniques. Cela représente un délai moyen supérieur de plus de 20 jours au délai de 60 jours.
Pour répondre à M. Amiel et à Mme Cohen, le tirage au sort, qui n'est pas remis en question, constitue un élément de prévention des conflits d'intérêts, mais il n'est pas le seul. Les membres experts externes des CPP sont tenus aux obligations de déclaration publique de leurs liens d'intérêts. Par ailleurs, le fonctionnement collégial des CPP ainsi que la complémentarité des collèges scientifiques et société civile participent de l'indépendance des avis.
M. Alain Milon , président . - Je rappelle que le rapporteur au Sénat de la proposition de loi présentée en 2009 par M. Jardé, député et professeur de médecine au centre hospitalier universitaire (CHU) d'Amiens, était Marie-Thérèse Hermange. En première lecture, les groupes socialiste et communiste se sont abstenus. Le texte, revenu au Sénat en novembre 2010, un an après, a été adopté en séance à l'unanimité le 20 décembre 2010. Après réunion d'une commission mixte paritaire, ce texte n'a finalement été définitivement adopté qu'en février 2012, soit près de trois ans après sa première présentation ! M. Jardé s'était d'ailleurs tellement impliqué qu'il a été battu lors des élections législatives dans sa circonscription -autre sujet de réflexion pour les élus...
Nous sommes désormais en 2018 et Mme Buzyn n'est ministre de la santé que depuis un an. La ministre précédente a mis cinq ans pour mettre en application le texte, à la suite de l'affaire Biotrial. Je tenais à vous donner ces éléments afin que notre réflexion soit complète sur le sujet.
EXAMEN DE L'ARTICLE UNIQUE
Article unique
L'article est adopté sans modification.
La proposition de loi est adoptée sans modification.
M. Alain Milon , président . - Le vote sur l'ensemble du texte en séance publique aura lieu le mardi 2 octobre à 17 h 45.
LISTE DES PERSONNES ENTENDUES
ET DÉPLACEMENT
___________
• Agence nationale de sécurité du médicament (ANSM)
Dominique Martin , directeur général
Carole Le Saulnier , directrice des affaires juridiques et réglementaires
Elodie Chapel , directrice des politiques d'autorisation et d'innovation
• Direction générale de la santé (DGS)
Céline Perruchon , sous-directrice de la politique des produits de santé et de la qualité des pratiques et des soins
Jean-Yves Lacoste , adjoint au chef du Bureau qualité des pratiques et recherches biomédicales
Sonia Ecarnot , juriste du Bureau qualité des pratiques et recherches biomédicales
• Coordonnateurs du 8 ème Conseil stratégique des industries de santé (CSIS)
Noël Renaudin
Vincent Lidsky
• Conférence nationale des présidents de comités de protection des personnes (CNCP)
Dr Louis Lacoste , président
Virginie Rage-Andrieu , vice-présidente de la CNCP et du CPP Sud Med IV (Montpellier)
Philippe Rusch , trésorier de la CNCP et président du CPP Sud Est I (Saint Étienne)
• Conseil consultatif national d'éthique pour les sciences de la vie et la santé (CCNE)
Pr Jean-François Delfraissy , président
• France Assos Santé
Christophe Demonfaucon , association française de personnes souffrant de troubles obsessionnels et compulsifs (Aftoc) et représentant des usagers en CPP
Claude Cottet , consommation logement cadre de vie (CLCV) et représentant des usagers en CPP
Marie Lanta , Ligue nationale contre le cancer
Yann Mazens , chargé de mission produits et technologies de la santé
• Agence régionale de santé d'Ile de France (ARS Ile-de-France)
Michel Huguet , directeur de la démocratie sanitaire
Franck Odoul , pharmacien inspecteur de santé publique
• Coordination des promoteurs institutionnels
Valérie Plattner , médecin responsable secteur promotion, direction de la recherche clinique et de l'innovation, hospices civils de Lyon
Serge Bureau , promoteur institutionnel à la direction de la recherche clinique et de l'innovation de l'APHP
• Comité national de coordination de la recherche (CNCR)
Marie Lang , directrice
Anne Le Louarn , juriste
Sylvie Deblois , chargée de la filière industrielle et des essais cliniques
• Inserm
Claire Giry , directrice générale
Hélène Espérou , directrice du pôle recherche clinique
• Leem
Philippe Lamoureux , directeur général
Thomas Borel , directeur des affaires scientifiques et RSE
Ariane Galaup-Pacy , directrice de la recherche clinique
Fanny de Belot , responsable des affaires publiques
Annaïk Lesbats , chargée de mission affaires publiques
• France Biotech
Alexandre Regniault , vice-président, avocat associé/partner, Simmons & Simmons LLP
• Syndicat national de l'industrie des technologies médicales (Snitem)
François-Régis Moulines , directeur affaires gouvernementales
Cécile Vaugelade , directrice affaires technico-réglementaires
• Commission nationale des recherches impliquant la personne humaine (Cnriph)
Pierre-Henri Bertoye , président
David Simhon , vice-président
* * *
• Déplacement CPP Ile-de-France 3 à l'hôpital Tarnier-Cochin
Pierre Loulergue , président
David Simhon , vice-président
Laurence Galbert , secrétaire
* 1 Déposée par les députés Cyrille ISAAC-SIBILLE et Philippe BERTA et les membres du groupe Mouvement démocrate (Modem) de l'Assemblée nationale.
* 2 Relative aux recherches impliquant la personne humaine, prise en application de l'habilitation de l'article 216 de la loi n° 2016-41 du 26 janvier 2016 de modernisation de notre système de santé.
* 3 Article L. 1121-1 du code de la santé publique.
* 4 Elles incluent différents types d'intervention tels que la première administration au volontaire sain d'un médicament pour en évaluer la tolérance et l'innocuité (essai de phase 1), les actes chirurgicaux, l'évaluation des dispositifs médicaux ou encore la thérapie cellulaire et génique.
* 5 Article L. 1121-4 du code de la santé publique.
* 6 Elles incluent des actes et interventions non invasifs tels que des prises de sang dans certaines conditions, des questionnaires dont les résultats peuvent donner lieu à une modification du protocole de traitement ou encore des examens radiologiques sans produit de contraste.
* 7 Elles incluent les prises de sang en-deçà d'un certain seuil, des tests génétiques, des questionnaires...
* 8 Hors modifications substantielles.
* 9 Recherches biomédicales.
* 10 Règlement (UE) n° 536/2014 du Parlement européen et du Conseil du 16 avril 2014 relatif aux essais cliniques de médicaments à usage humain et abrogeant la directive 2001/20/CE.
* 11 Niveau de protection, adéquation des moyens humains, matériels et techniques aux impératifs de sécurité, qualité des informations fournies aux participants et de la procédure destinée à obtenir leur consentement éclairé...
* 12 Notamment le caractère satisfaisant de l'évaluation des bénéfices et des risques attendus et le bien-fondé des conclusions pour les recherches interventionnelles non dénuées de risque.
* 13 Constitué de l'article unique L. 1124-1.
* 14 Premier président du Conseil consultatif national d'éthique (CCNE).
* 15 Et autant de suppléants qui s'investissent tout autant que les titulaires, si bien que les CPP fonctionnent généralement avec des effectifs dépassant les 14 membres.
* 16 Article R. 1123-4 du code de la santé publique.
* 17 Article R. 1123-14 du code de la santé publique.
* 18 Article R. 1123-14 du code de la santé publique.
* 19 Article R. 1123-13 du code de la santé publique.
* 20 Article R. 1123-13 du code de la santé publique.
* 21 Article R. 1125-19 du code de la santé publique.
* 22 En application des articles L. 1123-6, R. 1123-20 et D. 1123-34 du code de la santé publique.
* 23 Elle en comptait 51 en 1991 et devrait prochainement en compter 40, avec la création d'un CPP relevant du ministère de la défense en vue de traiter des protocoles relevant du secret défense.
* 24 « Chimeric Antigen Receptor » (CAR).
* 25 http://www.afmps.be/fr/humain/medicaments/medicaments/recherche_developpement/essais_cliniques .
* 26 - 33 % en France entre 2015 et 2017, contre - 14 % aux États-Unis et au Canada et - 16 % dans les cinq pays de référence de l'Union européenne (Allemagne, Espagne, France, Italie et Royaume-Uni).
* 27 Infrastructure F-Crin portée par l'Inserm dans le cadre du premier programme des investissements d'avenir (PIA 1).
* 28 Plan d'action sur les essais en oncologie, création de la cellule essais de phase précoce, projet d'optimisation de la gestion des essais cliniques initié en février 2018 et mise en place d'outil de pilotage et de suivi de dossier
* 29 Règlement (UE) n° 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux, modifiant la directive 2001/83/CE, le règlement (CE) n° 178/2002 et le règlement (CE) n° 1223/2009 et abrogeant les directives du Conseil n° 90/385/CEE et 93/42/CEE.
* 30 Une phase pilote sur l'évaluation des essais cliniques de dispositifs médicaux devrait s'engager, en France, en 2019.
* 31 La 8 e enquête du Leem, qui dresse un état des lieux de la recherche menée par l'industrie pharmaceutique sur le sol français entre le 1 er janvier 2014 et le 31 décembre 2015, a été établie en 2016, à partir des réponses de 30 entreprises du médicament représentant 62 % des parts du marché français du médicament.
* 32 Avec un maximum de 106 et un minimum de 54.
* 33 Auxquels s'ajoutent 185 modifications substantielles en moyenne par CPP déposées par les promoteurs.
* 34 Article R. 1123-23 du code de la santé publique.
* 35 Sur dix dossiers consécutifs traités par les CPP au cours du premier semestre 2018, à partir des réponses de 19 CPP.
* 36 La phase A. dépend de la complétude et de la lisibilité du projet, donc du promoteur.
* 37 La phase B. est un résultat de la désignation du CPP par tirage au sort (disponibilité, compétence et donc réactivité du CPP désigné).
* 38 La phase C. dépend du promoteur.
* 39 La phase D. dépend du CPP.
* 40 Dont la première phase a impliqué 21 CPP volontaires et la seconde devrait mobiliser l'intégralité des CPP.
* 41 229 de catégorie I, 373 de catégorie II et 237 de catégorie III.
* 42 De même que les demandes de modifications substantielles.
* 43 Composé de deux représentants de chacun des collèges, pouvant se prononcer à la majorité simple des membres et avec possibilité d'un seul rapporteur.
* 44 Utilisée, selon la coordination des promoteurs institutionnels, à hauteur de 8 % pour les recherches de catégorie II et de 17 % pour les recherches de catégorie III.
* 45 À titre d'exemple, le recueil de données génétiques ou d'autres types de données personnelles ne sont pas des recherches anodines et peuvent représenter un risque pour les volontaires.
* 46 Les 39 CPP doivent avoir été tirés au sort afin de pouvoir à nouveau être désignés.
* 47 Évolution des comités de protection des personnes (CPP) évaluant les projets de recherche impliquant la personne humaine, après la loi « Jardé » du 5 mars 2012, rapport n° 2013-103R de l'inspection générale des affaires sociales, janvier 2014.
* 48 Environ 54 euros net.
* 49 Selon une étude de 2017 de la CNRIPH, ont admis rencontrer de réelles difficultés dans le recrutement d'experts obligatoires : 3 CPP pour la pédiatrie, 7 CPP pour la phase 1 et 11 CPP pour la radioprotection.
* 50 Cette notion d'intérêt indirect semble recouvrir les risques de conflits d'intérêts « en miroir », lorsqu'un expert du CPP évaluerait le projet d'un concurrent hospitalo-universitaire.
* 51 Rapport d'information n° 569 (2017-2018) de M. Yves DAUDIGNY et Mmes Catherine DEROCHE et Véronique GUILLOTIN, intitulé Médicaments innovants : consolider le modèle français d'accès précoce, fait au nom de la mission d'évaluation et de contrôle de la sécurité sociale et de la commission des affaires sociales, déposé le 13 juin 2018.
* 52 D'AUTUME, C., ABALLEA, P., ROUSSILLE, B., La transformation des comités consultatifs de protection des personnes en matière de recherche biomédicale (CCPPRB) en comités de protection des personnes (CPP) en application de la loi du 9 août 2004 , rapport de l'Igas n° 2005-125, juillet 2005.
* 53 Rapport n° 908 du 9 mai 2018, fait au nom de la commission des affaires sociales sur la proposition de loi relative à l'expertise des comités de protection des personnes, par M. Cyrille Isaac-Sibille, député.
* 54 Un sondage des CPP par la Cnriph fait apparaître que les CPP rencontrent des difficultés à mobiliser de l'expertise dans les cinq domaines suivants : la pédiatrie, les essais de phase I, l'oncologie générale, l'oncologie-hématologie et la virologie. Néanmoins, certains CPP ont indiqué rencontrer les plus grandes difficultés à recruter spécialistes dans d'autres domaines, comme des ophtalmologues.
* 55 À titre d'exemple, un consortium de trois universités danoises et de l'entreprise BGI-Europe spécialisée dans l'analyse génomique ont développé une base de données cartographiant le génome complet de près de 150 familles danoises, en vue de renforcer la prédictibilité des affections et de favoriser la personnalisation des diagnostics et traitements.